
Lo sapete? Si può risparmiare fino a un milione nei prossimi tre (03) anni introducendo la Computer Software Assurance (CSA) al posto dell'attuale modello di convalida del sistema informatico (CSV)!
Nel corso degli anni, le organizzazioni farmaceutiche hanno incorporato il CSV, un approccio di convalida basato sul rischio per garantire che i sistemi operativi dei computer siano conformi ai requisiti normativi.
Mentre il settore si prepara alla prossima trasformazione (oltre all'approccio basato sul rischio), ovvero la CSA, USFDA in programma di pubblicare nel 2022 nuove linee guida sulla CSA per aiutare le organizzazioni a comprendere la qualità dei prodotti e la conformità normativa. Le linee guida dovrebbero fornire una chiara comprensione di come, dove e quali misure devono essere intraprese per condurre con successo una valutazione dei rischi del software.
Discutiamo ora in generale il confronto tra CSV e CSA dal punto di vista dei processi, delle persone e della tecnologia; e come un'implementazione di successo di CSA possa fornire vantaggi tangibili a un'organizzazione.
Processo
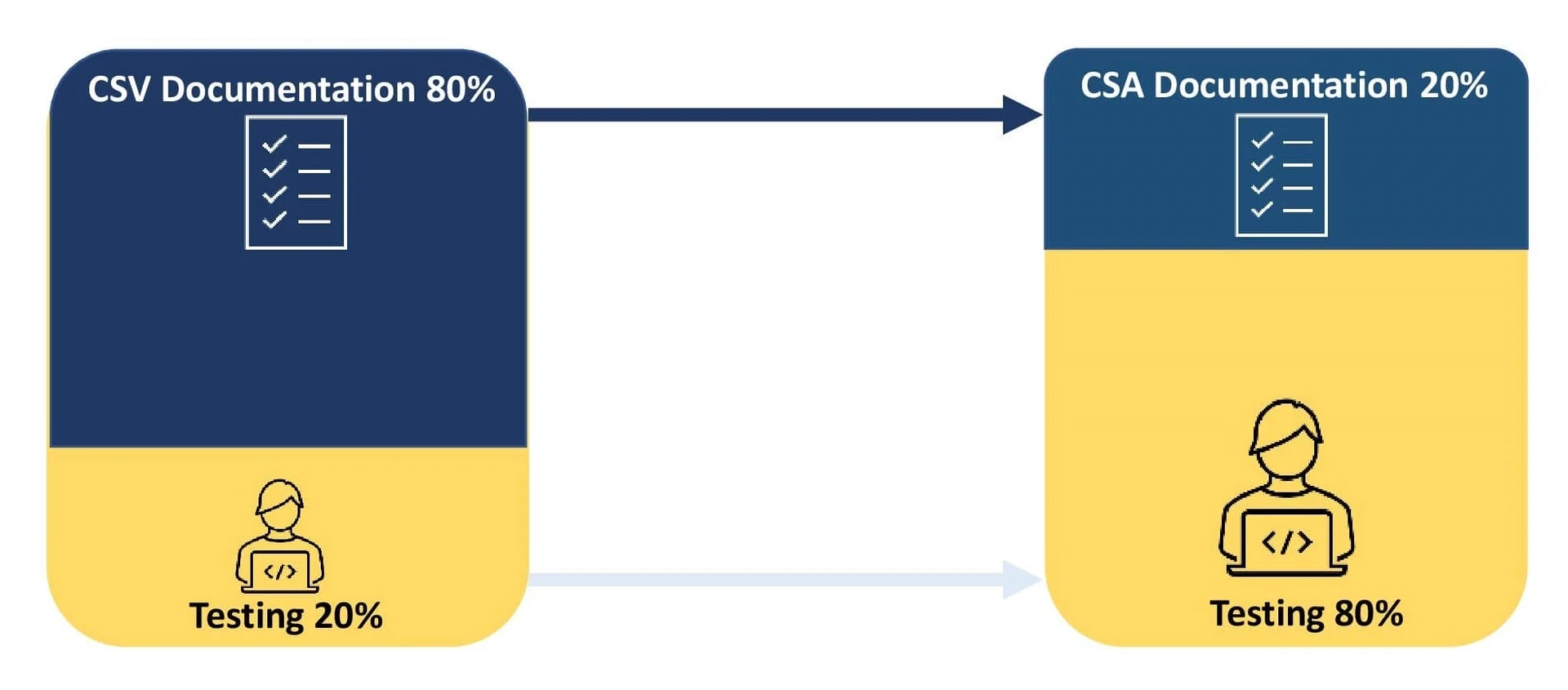
La convalida del sistema informatico (CSV) è un approccio documentato incentrato sulla conformità che funge da prova per garantire che il sistema sia adatto allo scopo previsto.
Un'organizzazione investe l'80% dei propri sforzi nella documentazione del processo di convalida e il 20% nei test. Qualsiasi discrepanza nei test CSV rispetto ai risultati attesi deve essere documentata e deve essere implementato un piano d'azione correttivo.
La Computer Software Assurance (CSA) è un approccio incentrato sulla qualità che sottolinea l'impatto del sistema software sulla sicurezza dei pazienti, sulla qualità del prodotto e sull'integrità dei dati.
L'obiettivo principale è quello di concentrarsi sulla convalida e sulla documentazione delle attività a rischio di sicurezza in base alla complessità del software. Questo approccio incoraggia l'uso della digitalizzazione e dell'automazione, migliorando così la qualità del prodotto. La riduzione del processo di documentazione aiuta le organizzazioni a reagire alle criticità del software e a conformarsi alle indicazioni delle autorità sanitarie. CSA sfrutta i sistemi di qualità dei fornitori per i test non scriptati e per la convalida dei sistemi a basso rischio, consentendo alle organizzazioni di investire l'80% degli sforzi nei test e il 20% nella documentazione.
Pertanto, i processi dovrebbero essere modificati (emendati) per riflettere l'approccio CSA nelle diverse fasi SDLC, il che può essere ottenuto:
- Qualità per progettazione (QbD) - Dare priorità alla sicurezza dei pazienti e alla qualità dei prodotti garantisce che l'obiettivo primario del sistema software installato sia quello di soddisfare i requisiti degli utenti per ottimizzare la qualità dei prodotti.
- La strategia di convalida basata sul rischio richiede test e documentazione attenti per i sistemi soggetti a guasti/difetti per i casi di rischio diretto e meno per i casi di rischio indiretto o nullo.
- Il ripensamento del rapporto tra documenti e test consente agli sponsor di ridefinire il processo di validazione, chiedendo loro di dedicare l'80% dello sforzo al test e il 20% alla documentazione.
- Fornisce vantaggi tangibili allentando la pressione sulla documentazione.
Persone
Il fattore di differenziazione tra CSV e CSA sta nella gerarchia della strategia. Il CSV osserva la documentazione seguita da test e pensiero critico, mentre al contrario il CSA osserva il pensiero critico come primo passo seguito da test e documentazione. La CSV dimostra con prove documentate l'efficienza e l'efficacia di un sistema computerizzato che svolge le attività secondo le specifiche e gli attributi di qualità prestabiliti. D'altra parte, la CSA raccomanda allo sponsor di tracciare i miglioramenti del processo per mitigare i rischi e i possibili errori.
A livello di leadership, è necessario ampliare il campo di applicazione del pensiero critico, prevedendo più modi per affrontare le situazioni di incertezza, poiché non esiste "un solo" modo giusto per ottenere un risultato. Il pensiero critico aprirà le porte all'innovazione per sviluppare prodotti affidabili.
A livello pratico e applicativo, formare le persone e prepararle a trasformarsi e adattarsi alla CSA attraverso una collaborazione efficace e programmi di formazione efficaci.
Prospettiva tecnologica
Esistono già linee guida complete sul CSV emanate da autorità di regolamentazione quali USFDA, EMA, MHRA e molte altre. Quindi, abbiamo bisogno del CSA? La risposta è sì. Il CSA metterà in prospettiva l'obiettivo della convalida e chiarirà la disparità tra sponsor e autorità sanitarie. Esistono normative adeguate e linee guida di settore che le organizzazioni farmaceutiche devono comprendere per ottenere vantaggi commerciali semplificando l'approccio al processo di convalida. Il passaggio dal CSV tradizionale al CSA sposta la priorità dell'organizzazione dal soddisfacimento dei requisiti di conformità normativa alla qualità e alla sicurezza dei prodotti. Tale cambiamento massimizza l'effetto del processo di convalida riducendo l'onere della documentazione, i tempi di realizzazione dei progetti e i costi per le aziende del settore delle scienze della vita.
A livello strategico e operativo, questo obiettivo può essere raggiunto incoraggiando la digitalizzazione e l'automazione, mitigando tutti i possibili rischi ed errori umani.
Conclusione
Poiché la guida della FDA statunitense sulla CSA non è ancora stata pubblicata, le organizzazioni farmaceutiche dovrebbero iniziare proattivamente a pensare e a definire i protocolli per la transizione dalla CSV alla CSA. Le organizzazioni devono:
- Rivalutare e identificare i sistemi che hanno un impatto diretto e indiretto sulla sicurezza dei pazienti, sulla qualità dei prodotti e sull'integrità dei dati.
- Assegnare risorse in grado di garantire un passaggio agevole nel processo di convalida.
- Eseguire un'analisi delle lacune rispetto al sistema esistente per identificare eventuali discrepanze.
La valutazione dell'approccio di convalida indica cosa può fare un'organizzazione per cambiare quando incontra un problema nel sistema. La corretta esecuzione del processo CSV richiede una comprensione approfondita del sistema e delle modalità di utilizzo.
La necessità del momento per le organizzazioni è quella di collaborare con esperti CSV nella moderazione di progetti semplici o complessi, in grado di aiutare in una transizione fluida da CSV a CSA. Un quadro di revisione della qualità riduce al minimo il lavoro di rielaborazione nel processo di convalida del prodotto e del fornitore, per garantire la totale conformità e convalida in qualsiasi fase durante l'implementazione, la manutenzione e la dismissione, a un prezzo estremamente competitivo. Reach Freyr la conformità.









