Evoluzione dei generici - Panoramica
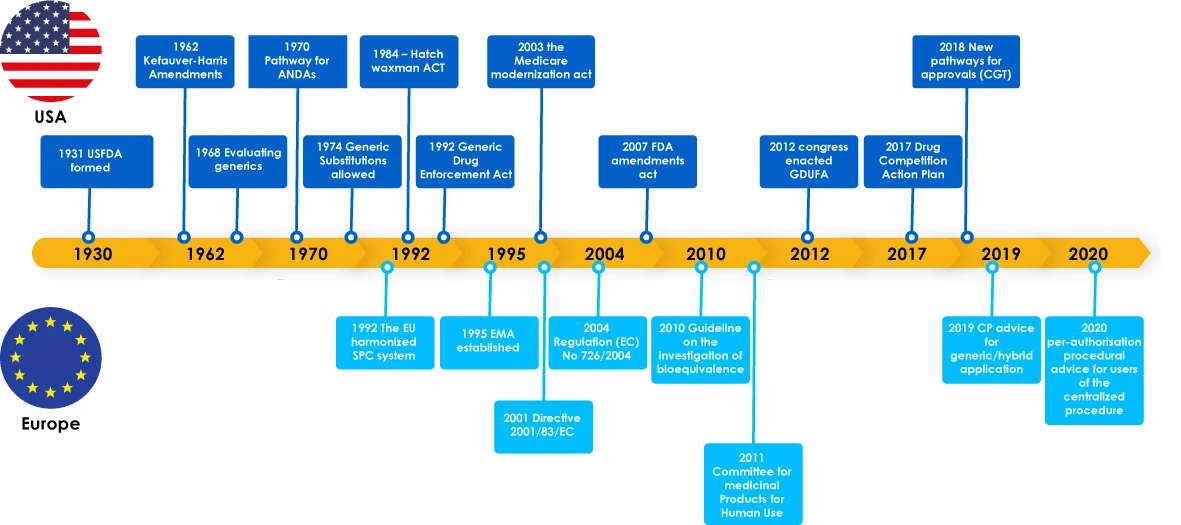
I medicinali generici hanno avuto importanti traguardi, tra cui leggi normative a supporto dello sviluppo dei generici, che hanno incoraggiato i produttori a esplorare il mercato dei generici. Queste legislazioni hanno anche fornito ai medici la fiducia di prescrivere un sostituto per un farmaco di marca e alla fine hanno beneficiato i pazienti, poiché i produttori di generici hanno soddisfatto le esigenze critiche dei pazienti in tutto il mondo.
Domande frequenti sui generici
D1: Cosa sono i farmaci generici?
Ans: I farmaci generici sono farmaci farmaceutici che sono copie identiche del prodotto farmaceutico originatore e hanno lo stesso API, dosaggio, uso previsto, effetti collaterali, via di somministrazione, rischi, sicurezza e potenza del farmaco innovatore, ma possono differire in alcune caratteristiche come il processo di produzione, la formulazione, gli eccipienti, il colore, il gusto e il confezionamento. In altre parole, un farmaco generico è terapeuticamente equivalente a un farmaco di marca e, pertanto, può essere sostituito dalla sua controparte di marca.
D2: Perché i farmaci generici costano meno di un farmaco innovativo?
Ans: I farmaci generici sono più efficaci dal punto di vista dei costi rispetto ai farmaci innovatori, perché questi ultimi non devono ripetere i costosi e lunghi studi preclinici e clinici richiesti dai farmaci innovatori per dimostrare la sicurezza e l'efficacia; i farmaci generici devono invece dimostrare solo l'equivalenza farmaceutica del loro prodotto.
D3: I farmaci generici sono altrettanto validi dei farmaci innovativi?
Risposta: Sì, i farmaci generici hanno la stessa qualità, efficacia e sicurezza dei farmaci di marca. Il prezzo più basso di questi farmaci non indica che siano di qualità inferiore, perché i farmaci generici, proprio come i farmaci di marca, devono passare attraverso un rigoroso processo di approvazione dei farmaci per poter essere commercializzati e le aziende farmaceutiche sono tenute a presentare la domanda di autorizzazione per i farmaci generici, dimostrando che il loro prodotto ha gli stessi benefici clinici dei farmaci di marca ed è adatto a essere utilizzato come sostituto del rispettivo farmaco di marca.
D4: Perché i farmaci generici hanno un aspetto diverso da quello dei farmaci di marca?
Risposte: i prodotti farmaceutici generici devono essere bioequivalenti ai farmaci di marca e avere lo stesso API dei farmaci innovativi. Tuttavia, i farmaci generici possono presentare differenze minime per quanto riguarda la forma, l'etichettatura (differenze minori), l'imballaggio e gli ingredienti inattivi come colori, aromi e conservanti; ma l'efficacia del farmaco deve rimanere la stessa.
Q5: Cosa comporta la revisione e l'approvazione delle domande di farmaci generici negli US?
Risposta: Qualsiasi azienda farmaceutica che intenda commercializzare il proprio farmaco generico negli US deve rispettare tutti i requisiti normativi della US FDA per la registrazione dei farmaci generici e deve dimostrare che:
- Il farmaco generico è "Farmaceuticamente/Terapeuticamente equivalente" al farmaco di marca.
- Il produttore è in grado di produrre il farmaco in modo corretto e coerente
- Il "principio attivo" è lo stesso di quello della marca
- La giusta quantità di principio attivo arriva nel punto dell'organismo in cui ha effetto
- Gli ingredienti "inattivi" del farmaco sono sicuri
- Il farmaco non si degrada nel tempo
- Il contenitore in cui il farmaco sarà spedito e venduto è appropriato.
- L'etichetta è uguale a quella del farmaco di marca
- I brevetti o le esclusive legali sono scaduti.
D6: Ogni farmaco di marca ha un farmaco generico?
Ans: No. Ogni farmaco di marca non ha una versione generica. I nuovi farmaci vengono prodotti sotto tutela brevettuale per un massimo di venti (20) anni. Ciò significa che durante questo periodo non possono essere prodotti e commercializzati altri farmaci, fino alla scadenza del brevetto. Tuttavia, alcuni farmaci potrebbero non avere mai una versione generica per il loro prodotto, a causa della difficoltà di produzione o nel caso in cui il prodotto generico possa risultare non redditizio.




