Servizi di conformità, audit e convalida - panoramica
Siete conformi? È una domanda a cui ogni azienda farmaceutica, biotecnologica, genomica, chimica, di dispositivi medici e di gestione della catena di fornitura trova difficile rispondere. Queste organizzazioni devono rispettare i severi requisiti di qualità, sicurezza e conformità in ogni area geografica in cui vengono distribuiti i loro prodotti. L'attuale tendenza della gestione della conformità normativa si sta spostando verso l'armonizzazione globale della qualità e della sicurezza. Che siate produttori o fornitori, la vostra espansione sul mercato, il miglioramento continuo e la soddisfazione dei clienti dipendono principalmente dagli standard di qualità della vostra azienda. Il Centro di eccellenza per la conformità normativa, l'audit e la convalidaCoE) di Freyrpuò contribuire a questo sforzo assistendovi con servizi professionali di conformità, audit e convalida per i settori farmaceutico, dei dispositivi medici, dei beni di consumo e sanitario, come le cGMP (Current Good Manufacturing Practices), le GCP (Good Clinical Practice), le GDP (Good Distribution Practice), le Good Laboratory PracticeGLP), le GPVP (Good Pharmacovigilance Practice) e la GxP Computer System Validation (CSV).
Freyr fornisce servizi di conformità normativa, audit e convalida che prevedono la valutazione dei vostri requisiti e la proposta di input per i processi aziendali volti a garantire la soddisfazione del cliente. Con le nostre strategie di preparazione e preparazione dei rapporti di audit di conformità, forniamo rapporti di conformità e di audit (analisi delle lacune), comprese le azioni correttive e preventive (CAPA) suggerite per evitare potenziali 483 e risultati di audit di conformità da parte delle autorità di regolamentazione.
Forniamo servizi di convalida e conformità normativa per garantire che tutti i vostri processi e prodotti siano allineati con i requisiti di qualità, sicurezza delle informazioni e audit di conformità normativa applicabili, quali (ma non solo) i seguenti:
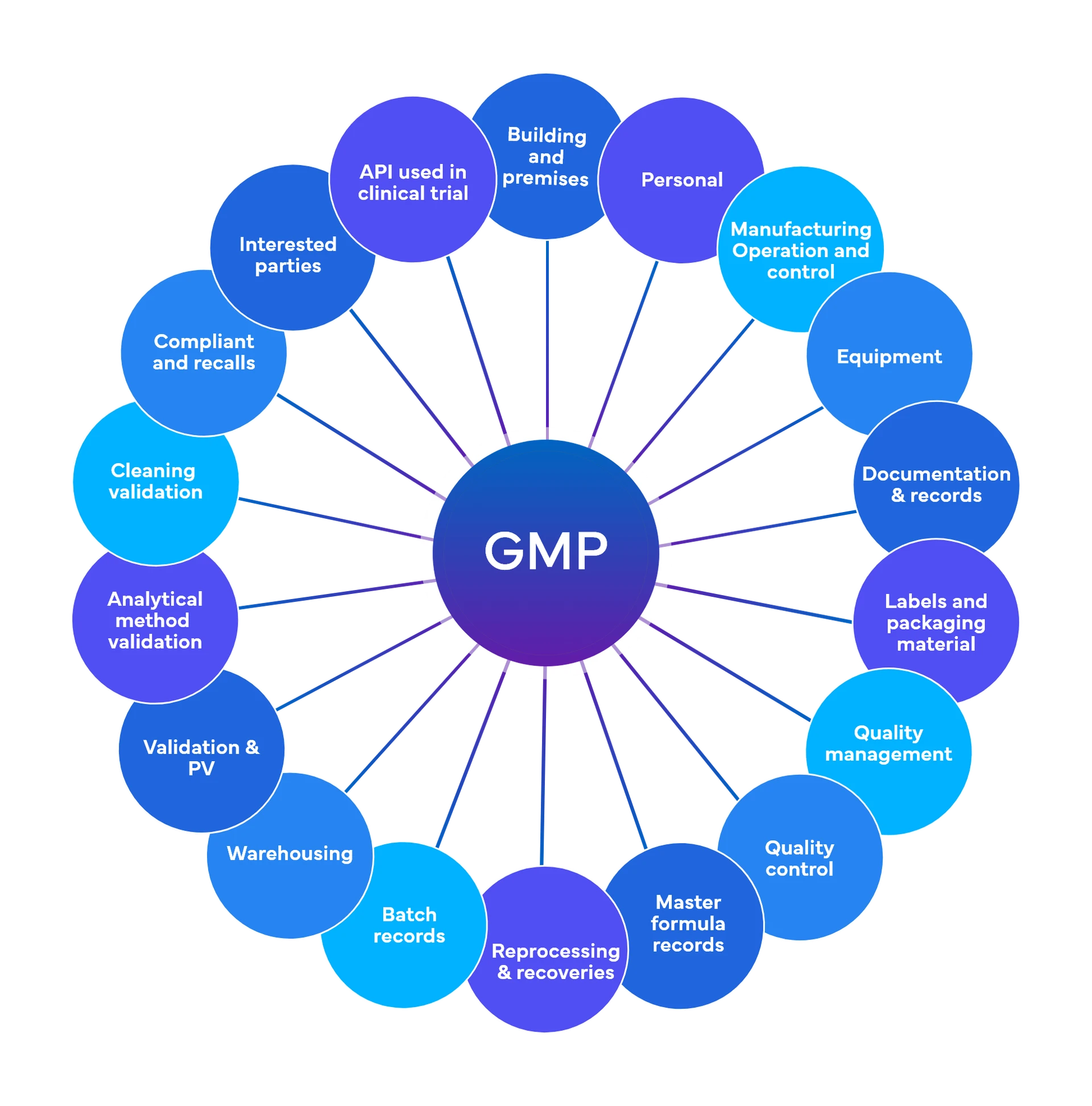
Freyr esegue circa 700 controlli a livello preliminare, distribuiti in 18-19 aree funzionali GMP.
Conformità, audit e convalida di Freyr
Servizi di conformità, audit e convalida
Qualità e conformità normativa - Buone pratiche di fabbricazione correnti (cGMP)
- ISO / IEC 17025: 2017 - Requisiti generali per la competenza dei laboratori di prova e taratura
- OCSE (Organizzazione per la Co e lo Sviluppo Economico) - Linee guida di buona pratica di laboratorio
- Guida EURACHEM / CITAC: Guide to Quality in Analytical Chemistry - An Aid to Accreditation, 3rd Edition (2016), deve essere seguita nelle procedure analitiche.
- 21 CFR 58: Buona pratica di laboratorio per gli studi di laboratorio non clinici
- Guida ai regolamenti GLP del Regno Unito, febbraio 2000 (a cura della GLPMA)
- Manuale dellWHO sulle buone pratiche di laboratorioGLP): Pratiche di qualità per la ricerca e lo sviluppo non clinici regolamentati
- Health Canada: Documento guida finalizzato - Dati di studi di laboratorio non clinici a supporto delle domande e delle presentazioni di prodotti farmaceutici: Aderenza alla buona pratica di laboratorio
- Standard OSHA (Occupational Safety and Health Administration)
- Linee guida ICH applicabili
Buona pratica di laboratorio
- ISO / IEC 17025: 2017 - Requisiti generali per la competenza dei laboratori di prova e taratura
- OCSE (Organizzazione per la Co e lo Sviluppo Economico) - Linee guida di buona pratica di laboratorio
- Guida EURACHEM / CITAC: Guide to Quality in Analytical Chemistry - An Aid to Accreditation, 3rd Edition (2016), deve essere seguita nelle procedure analitiche.
- 21 CFR 58: Buona pratica di laboratorio per gli studi di laboratorio non clinici
- Guida ai regolamenti GLP del Regno Unito, febbraio 2000 (a cura della GLPMA)
- Manuale dellWHO sulle buone pratiche di laboratorioGLP): Pratiche di qualità per la ricerca e lo sviluppo non clinici regolamentati
- Health Canada: Documento guida finalizzato - Dati di studi di laboratorio non clinici a supporto delle domande e delle presentazioni di prodotti farmaceutici: Aderenza alla buona pratica di laboratorio
- Standard OSHA (Occupational Safety and Health Administration)
- Linee guida ICH applicabili
Buona Pratica Clinica (GCP) e Buona Pratica di Farmacovigilanza (GVP)
- Linea guida tripartita armonizzata ICH : Linea guida per la buona pratica clinica - E6
- E2B(R3) Rapporto sulla sicurezza del caso individuale (ICSR) Specifiche e file correlati
- E2C(R2) Rapporto periodico di valutazione dei rischi e dei benefici (PBRER)
- Altre linee guida ICH applicabili
- Linee guida sulle buone pratiche di farmacovigilanza (GVP) Moduli
- Requisiti di segnalazione della sicurezza della FDA per IND e studi BA/BE
- Segnalazione della sicurezza post-marketing per i prodotti farmacologici e biologici per uso umano, compresi i vaccini
- Specifiche di attuazione regionale FDA per la segnalazione di ICH E2B(R3) al sistema di segnalazione degli eventi avversi FDA (FAERS)
- Fornitura di documenti in formato elettronico - Domande e risposte tecniche sugli ICSR post-mercato non inediti
- Pianificazione della farmacovigilanza E2E
Sicurezza delle informazioni, privacy dei dati e convalida dei sistemi informatici (CSV)
- ISO 27001: 2013 Tecnologia dell'informazione - Tecniche di sicurezza - Sistema di gestione della sicurezza delle informazioni - Requisiti
- ISO 27002: 2013 Tecnologia dell'informazione - Tecniche di sicurezza - Codice di prassi per la gestione della sicurezza delle informazioni
- USFDA 21 CFR Part 11: Registrazioni elettroniche; firme elettroniche - Ambito e applicazione
- Guida GMP dell'UE Allegato 11
- Notifica della linea guida ERES giapponese n. 0401022
- GAMP 5: un approccio basato sul rischio per la conformità dei sistemi computerizzati GxP
- USFDA - Linee guida per la convalida del software
- Linee guida ICH QSEM applicabili
- Pianificare e creare SOP e controllare le strutture di produzione.
- Modello di processo integrato
- Mantenere l'immagine del marchio
- Servizi di valutazione del rischio
- Risparmi complessivi sui costi
- Implementare processi aziendali efficaci e conformi
- Stabilire strategie di convalida e qualificazione
- Competenze in materia di conformità normativa e di audit
- Esperti revisori di conformità


 Servizi di conformità e audit
Servizi di conformità e audit







