Panoramica sulla registrazione dei dispositivi medici Health Canada
Il Canada, grazie a linee guida molto severe, dispone di uno dei migliori sistemi di regolamentazione al mondo per i dispositivi medici. In Canada, tutti i dispositivi medici sono regolamentati da Health Canada, Health Products and Food Branch, Therapeutic Products Directorate, Medical Devices Bureau. Health Canada esamina i dispositivi medici per valutarne la sicurezza, l'efficacia e la qualità prima di autorizzarne la vendita in Canada, come previsto dal regolamento sui dispositivi medici SOR/98-282, attuato nel 1998. Freyr è stato un partner attivo delle aziende produttrici di dispositivi medici per aiutarle a rispettare le linee guida per la registrazione dei dispositivi medici Health Canada .
Autorità di regolamentazione: Health Canada
Regolamento: Regolamento sui dispositivi medici (SOR/98-282)
Rappresentante autorizzato: Non richiesto
Requisito del SGQ: Conformità alla norma ISO 13485:2016 come Medical Device Single Audit Program MDSAP)
Valutazione dei dati tecnici: Health Canada
Validità della licenza: Illimitato
Requisiti di etichettatura: Parte 21 di MDR (SOR/98-282)
Formato di presentazione: Carta
Lingua: Inglese e francese
Classificazione dei dispositivi medici Health Canada
Il sistema di classificazione dei dispositivi medici Health Canada è mutuato in modo significativo dalla Direttiva 93/42/CEE del Consiglio dell'Unione Europea. Molte delle regole e delle interpretazioni dei termini sono simili a quelle proposte dall'Unione Europea. Tuttavia, non è necessariamente vero che un dispositivo medico classificato in una classe secondo il sistema di classificazione dell'Unione Europea sarà classificato nella stessa classe in base al sistema di classificazione dei dispositivi medici del Canada. Il richiedente deve seguire le regole stabilite nei Regolamenti per determinare la classificazione appropriata per il proprio dispositivo in Canada.
Per creare le regole di classificazione canadesi sono stati utilizzati i seguenti indicatori di rischio posti da un determinato dispositivo: grado di invasività, durata del contatto, sistema corporeo interessato ed effetti locali o sistemici.
| Classe del dispositivo | Il rischio |
|---|---|
| I | Basso |
| II | Basso-Moderato |
| III | Alto-Moderato |
| IV | Alto |
Canada Rappresentante autorizzato
Il produttore non è tenuto a nominare un rappresentante autorizzato in Canada. Il distributore, tuttavia, deve rispettare i requisiti di Health Canada per le buone pratiche di distribuzioneGDP).
Registrazione dei dispositivi medici in Canada
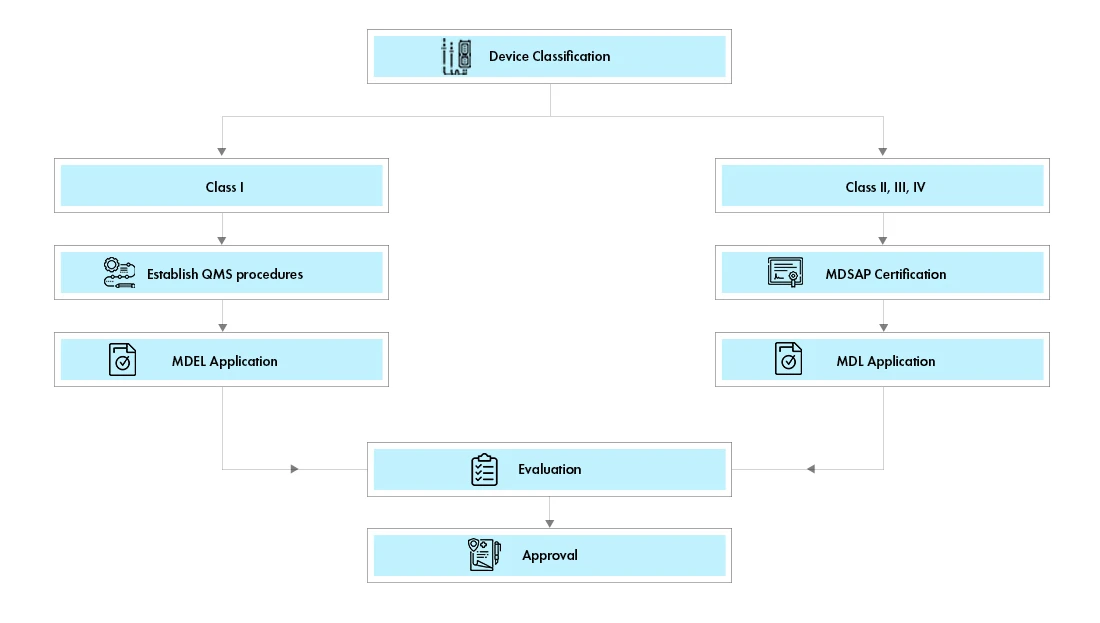
In Canada esistono due percorsi per la registrazione dei dispositivi medici:
Licenza di stabilimento di dispositivi medici (MDEL): I dispositivi di classe I possono richiedere la Medical Device Establishment License Canada (MDEL) preparando le procedure obbligatorie e pagando le tasse di Health Canada .
Licenza per dispositivi medici (MDL): I dispositivi di classe II, III e IV devono richiedere una licenza canadese per dispositivi medici (MDL). I requisiti documentali per ciascuna classe di dispositivi variano.
Flusso di processo
Gestione del ciclo di vita del dispositivo dopo l'approvazione
Freyr supporta i produttori esteri nella gestione End-to-End del ciclo di vita dei dispositivi medici, incluse le attività post-approvazione, come:
- Gestione delle modifiche post-approvazione - modifiche alle approvazioni dei dispositivi medici esistenti, come l'aggiunta di nuove varianti e accessori, l'aggiunta di nuove indicazioni d'uso, ecc.
- Mantenimento delle approvazioni e della registrazione attraverso il pagamento puntuale delle tasse amministrative e di registrazione.
- Rinnovo delle licenze
- Collegamento tra Health Canada e il produttore
Sintesi
| Il rischio | Classe del dispositivo | Audit del SGQ | Percorso normativo | Requisiti del documento | Tempistiche di Health Canada |
|---|---|---|---|---|---|
| Basso | I | NA | MDEL |
| NA |
| Basso-Moderato | II | Certificato MDSAP | MDL |
| 15 giorni |
| Alto-Moderato | III | Certificato MDSAP | MDL |
| 60 giorni |
| Alto | IV | Certificato MDSAP | MDL |
| 75 giorni |
Servizi di registrazione dei dispositivi medici di Freyr
Competenza di Freyr
- Servizi di classificazione e raggruppamento dei dispositivi medici Health Canada
- Registrazione dei dispositivi medici, Canada
- Riunioni di pre-presentazione con Health Canada
- MDSAP, Canada
- Identificazione del distributore/Qualificazione del distributore per la conformità ai requisiti di Health Canada
- Licenza di stabilimento di dispositivi medici Canada (MDEL)
- Licenze per dispositivi medici in Canada (MDL)
- Gestione delle modifiche successive all'approvazione
- Servizi di etichettatura in base ai requisiti di etichettatura di Health Canada per i dispositivi medici.