Panoramica di FDA eSTAR
L'iniziativa FDA eSTAR è stata formulata per migliorare l'efficienza e l'uniformità nella preparazione e nella valutazione delle domande FDA 510(k) e De Novo. Partendo dall'approccio iniziale di eSubmitter, che prevedeva la presentazione elettronica dei dispositivi medici e delle domande IVD, è stato istituito il programma eSTAR, sulla base dell'esperienza precedente dell'FDA. L'FDA ha sperimentato un programma diverso, denominato Electronic Submission Template and Resource (eSTAR) Pilot Program. A partire dal 1° ottobre 2023, le domande 510(k) (tradizionali, abbreviate o speciali) dovranno utilizzare il programma eSTAR. I modelli sono disponibili per l'accesso online, anche se richiedono l'uso delle credenziali dell'account FDA per l'effettivo processo di presentazione.
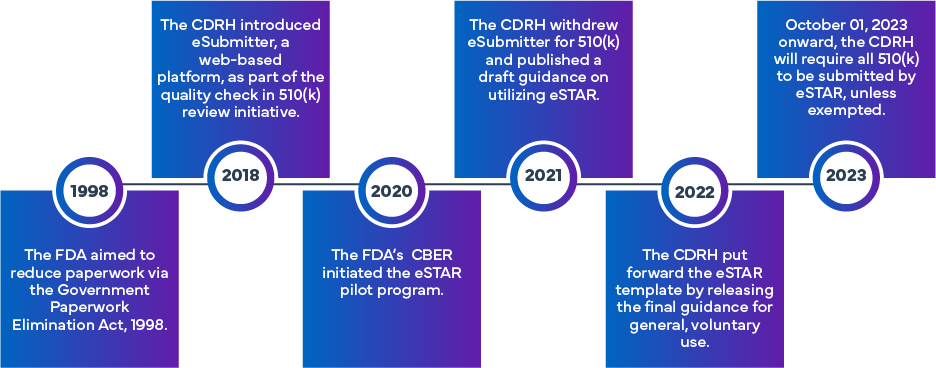
Che cos'è l'FDA eSTAR?
L'eSTAR è un modello PDF interattivo progettato per facilitare la preparazione di una presentazione completa pre-commercializzazione di dispositivi medici per il processo di autorizzazione 510(k) della FDA negli US. Inoltre, i richiedenti possono utilizzare l'eSTAR per inviare risposte alle richieste di informazioni aggiuntive della FDA. Il suo obiettivo è migliorare la qualità delle presentazioni per vari dispositivi medici, garantendo che i mittenti forniscano dati completi e di alta qualità per la revisione pre-commercializzazione della FDA./p>
Adottando il formato eSTAR, i proponenti possono essere sicuri della completezza delle loro proposte, che a loro volta consentiranno all'FDA di condurre le revisioni pre-market in modo più efficiente e di garantire un accesso tempestivo a dispositivi medici sicuri ed efficaci. Il modello eSTAR è disponibile gratuitamente e può essere utilizzato volontariamente da tutti i fornitori di dispositivi medici per la presentazione di 510(k), De Novo e Q all'FDA. Esistono due tipi di modelli eSTAR: uno per i dispositivi medici e l'altro per gli IVD. Il 9 giugno 2023, l'FDA ha rilasciato una versione beta di eSTAR (PreSTAR) per le pre-submissioni (un tipo di presentazione Q).
Caratteristiche e limiti delle candidature eSTAR
Sebbene il programma eSTAR offra un modulo PDF interattivo progettato per assistere i richiedenti nella stesura di una presentazione completa di dispositivi medici e IVD, esso presenta sia vantaggi che svantaggi. I richiedenti devono comprendere questi vantaggi e limiti, in base ai quali possono fare scelte ben informate sull'integrazione di eSTAR nel loro processo di presentazione. Nella tabella che segue, analizzeremo le caratteristiche e le limitazioni del programma eSTAR.

Considerazioni per un uso efficace di eSTAR
Una caratteristica vantaggiosa del modello eSTAR, che contribuisce all'ottimizzazione del processo di presentazione, è l'incorporazione automatica delle normative pertinenti e degli standard riconosciuti per la citazione. Ciò non solo accelera il processo di presentazione riducendo l'inserimento manuale dei dati, ma attenua anche la possibilità di errori umani che potrebbero verificarsi durante l'inserimento di normative e standard. Grazie alla costruzione guidata per ogni sezione di presentazione, l'utilizzo di eSTAR nel processo di presentazione può essere semplificato senza sforzo.
- La FDA suggerisce Adobe Acrobat Pro o Foxit PDF Editor per la modifica dei modelli eSTAR.
- eSTAR include alcuni moduli integrati, eliminando così la necessità di compilazione separata. Si tratta del Modulo 3514 (il foglio di presentazione) e del Modulo 3881 (indicazioni d'uso). Inoltre, la dichiarazione di veridicità e accuratezza, che in precedenza era richiesta sulla carta intestata dell'azienda, è ora integrata in eSTAR.
- eSTAR supporta diversi formati di allegati oltre ai PDF, come fogli di calcolo Excel e file video (mp4).
- Non sono ammessi file in formato macro ed eseguibile.
- La dimensione totale del file eSTAR PDF, insieme agli allegati, non deve superare 1 GB, in quanto non saranno accettati file di dimensioni superiori a 4 GB.
- Se i file elettronici superano i limiti tecnici, è possibile inviare l'invio digitale al CDRH Document Control Center (DCC) per posta.
Migliori pratiche per la preparazione delle domande eSTAR
Seguire alcune delle migliori pratiche per la preparazione delle domande eSTAR può aiutare i richiedenti a snellire il processo di presentazione e a migliorare le possibilità di successo. Ecco alcune buone pratiche:
- Rispettare le linee guida della FDA : La FDA offre una guida per aiutare i richiedenti a utilizzare con successo il modello eSTAR. L'osservanza di queste linee guida assicura che le proposte siano in linea con i requisiti e le aspettative dell'FDA.
- Garantire la completezza: Il modello eSTAR guida i richiedenti attraverso le informazioni essenziali da presentare. I richiedenti devono fornire tutti i dettagli richiesti per ridurre al minimo le possibilità di carenze o di richieste di informazioni aggiuntive.
- Mantenere la coerenza: Il modello eSTAR favorisce l'uniformità del contenuto e della struttura delle richieste 510(k). La costruzione guidata di ogni sezione della richiesta aiuta a estrarre le informazioni sul dispositivo medico.
- Privilegiare la chiarezza: Fornire dettagli chiari e concisi nelle richieste eSTAR per facilitare un processo di revisione semplificato. Tali dettagli e precisione riducono al minimo i ritardi e gli errori, garantendo inoltre un accesso tempestivo alle richieste di autorizzazione all'immissione in commercio dei dispositivi medici.
- Precisione sicura: La verifica automatica delle informazioni contenute in ogni sezione delle richieste eSTAR aiuta a ridurre i ritardi di revisione e le potenziali carenze.
Significato della codifica dei colori nella presentazione di FDA eSTAR
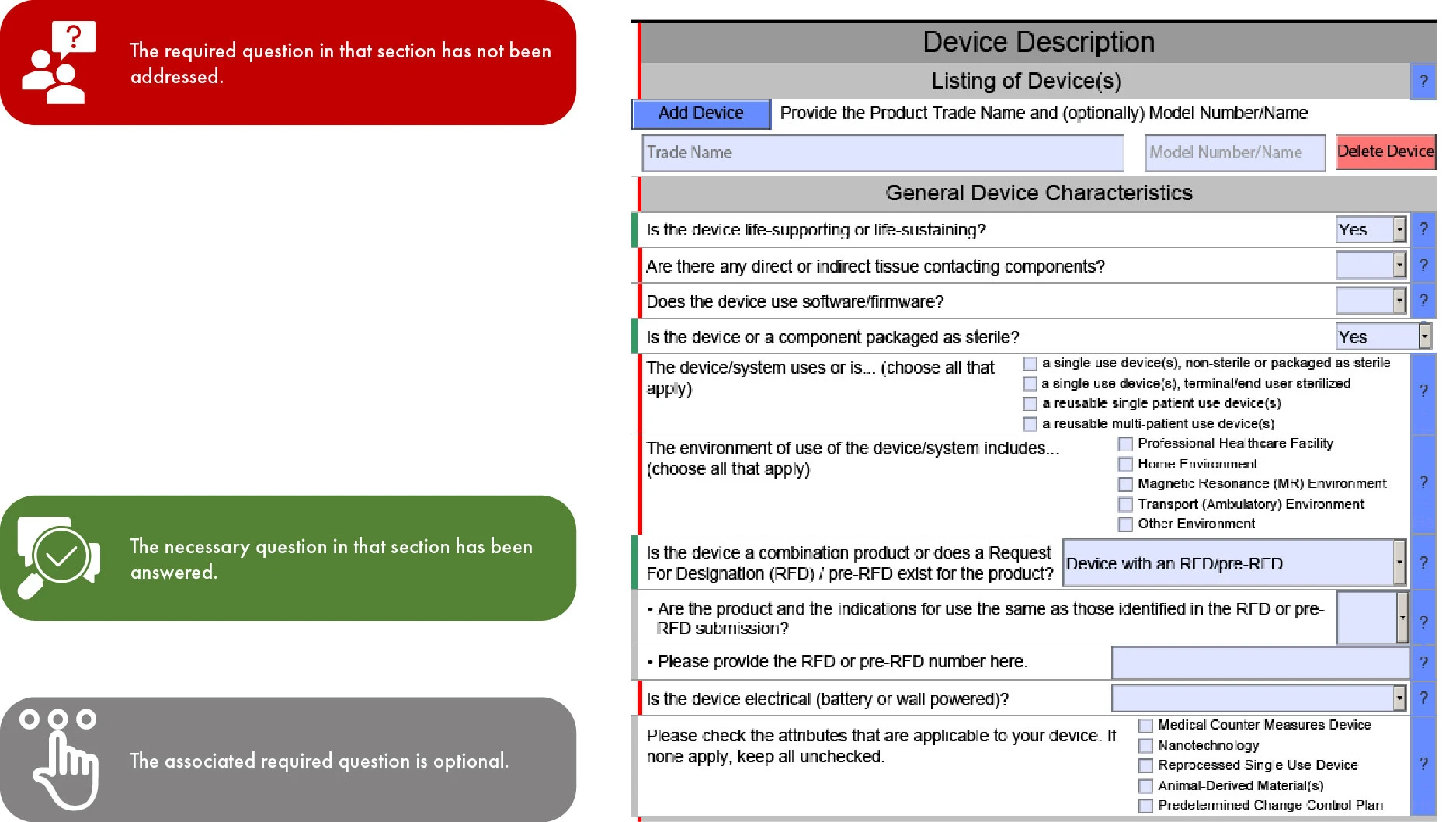
Poiché eSTAR diventerà obbligatorio per le sottomissioni 510(k) a partire dal 1° ottobre 2023 e sarà volontario per De Novo, la progressione del modello attraverso le sezioni è determinata dal tipo di sottomissione. Questo tipo di semplificazione facilita una revisione più rapida da parte della FDA statunitense, minimizzando così le incongruenze e le omissioni nella tua sottomissione. Tuttavia, è importante notare che la FDA potrebbe ritardare la sua revisione se mancano le traduzioni in inglese per la documentazione fornita.

Allineare gli allegati
Esaminate prima il modello eSTAR per capire come sono suddivisi gli allegati e assicuratevi che i vostri documenti siano in linea con le sezioni degli allegati. Questa fase è fondamentale, in particolare per le aziende che hanno già presentato una 510(k), poiché l'approccio esistente all'organizzazione dei documenti potrebbe richiedere degli aggiustamenti. Potrebbe essere necessario estrarre il contenuto dagli allegati.
- eSTAR richiede allegati concisi, diversi da quelli tradizionali.
- Aspettatevi numerosi allegati, potenzialmente decine.
- Gli allegati consentono di inserire dati come fogli di calcolo Excel, file video MP4, documenti Word, file JPEG, ecc.
- eSTAR vuole i numeri di pagina per le informazioni sugli allegati, ma non suggerisce l'uso di una lista di controllo per il rifiuto di accettazione per le linee guida FDA .
Modelli: I modelli sono accessibili nel link fornito: https:fda
Il futuro di eSTAR
Si prevede che eSTAR subirà aggiornamenti al momento della finalizzazione di documenti guida applicabili e completi. Con questi aggiornamenti, il produttore potrà fare riferimento alle versioni più recenti rilasciate dalla US FDA
Health Canada (HC) ha introdotto un'iniziativa pilota per l'impiego di eSTAR per i dispositivi di Classe III e IV. Si ipotizza che altre nazioni possano emulare il Canada rendendo discrezionale l'adozione di eSTAR, in particolare all'interno del consorzio IMDRF. Tuttavia, va notato che non ci sono state dichiarazioni esplicite in tal senso.
Perché scegliere Freyr?
Freyr vanta una grande esperienza acquisita grazie al suo coinvolgimento in numerosi progetti di presentazione alla FDA . Presentando un doppio percorso per assistere in modo proattivo l'industria nell'accelerazione delle richieste 510(k) e De Novo, Freyr fornisce una serie di servizi ai clienti, che comprendono un elenco completo dei documenti di presentazione essenziali e delle informazioni richieste, la conduzione di meticolose analisi delle lacune della documentazione, la compilazione delle richieste tramite eSTAR e la finalizzazione del pacchetto di presentazione pre-market all'FDA. Inoltre, Freyr estende il suo supporto alle attività successive alla presentazione, come la fornitura di informazioni aggiuntive e la revisione delle risposte dell'industria a qualsiasi richiesta di informazioni supplementari da parte dell'FDA.
In che modo Freyr può aiutare?
Freyr offre un supporto che può essere utile per prepararsi alla presentazione di 510(k) e De Novo. I servizi comprendono:
- Supporto al percorso normativo: Si tratta di identificare il codice del prodotto, il nome e il numero della normativa, i potenziali dispositivi di riferimento, i test di prestazione, nonché gli standard e i documenti guida applicabili relativi allo specifico dispositivo in questione.
- Assistenza per la presentazione di domande (pre-submission): Si tratta di assistere il cliente nel chiarire le domande relative ai prerequisiti di una presentazione pre-market, nell'organizzare la presentazione, nel prepararsi a un incontro con FDA , nell'interagire con l'FDA durante l'incontro in modo interattivo e nel redigere il verbale dell'incontro.
La competenza del programma eSTAR FDA
- Strategia normativa completa FDA .
- Identificazione del dispositivo predicato.
- Stabilire l'equivalenza sostanziale con il dispositivo predicato.
- Analisi delle lacune per la conformità alla FDA .
- Compilazione di ventuno (21) sezioni del fascicolo tecnico 510(k).
- Pubblicazione e creazione dell'eCopy.
- Convalida e invio dell'eCopy.
- Collegamento con i servizi per l'approvazione del dispositivo.
- L'indirizzamento della risposta e delle carenze dell'ACR.
- Servizi di consulenza per risolvere le carenze.
- Elenco dei dispositivi e manutenzione del database FURLS.