Rapporto di validità scientifica (SVR) Panoramica
Il Rapporto di validità scientifica (SVR) riveste un'importanza fondamentale all'interno del Rapporto di valutazione delle prestazioni (PER) per i dispositivi medico-diagnostici in vitro (IVD), secondo il Regolamento sui dispositivi medico-diagnostici in vitro dell'Unione Europea (EU IVDR) 2017/746. L'SVR svolge un ruolo cruciale nella validazione scientifica delle prestazioni analitiche e cliniche del dispositivo, garantendo la sicurezza e l'efficacia dei dispositivi medici disponibili sul mercato. Nell'ambito del processo di valutazione della conformità prescritto dall'EU IVDR, i produttori sono tenuti a presentare un PER, che deve includere un SVR, a un organismo notificato per dimostrare la sicurezza e le prestazioni del dispositivo prima della sua immissione sul mercato dell'UE.
Rapporti di validità scientifica per la presentazione di IVDR nell'UE
- Analisi e conclusioni
Qual è il contenuto del Rapporto di Validità Scientifica (SVR)?
Per validità scientifica di un analita si intende l'associazione di un analita con una condizione clinica o uno stato fisiologico. La validità scientifica di un IVD si basa principalmente su una o una combinazione delle seguenti fonti:
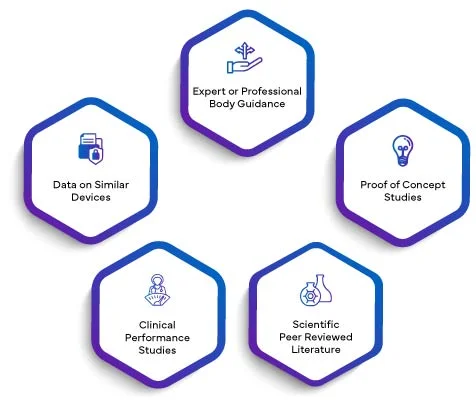
I dati di tutto quanto sopra, se applicabile, saranno redatti in una relazione di validità scientifica. Integrando l'SVR nel PER, i produttori elevano la loro valutazione delle prestazioni a un livello superiore di credibilità. La validità scientifica stabilita tramite l'SVR conferisce al PER una base solida, migliorandone la qualità e il significato complessivi. Ciò, a sua volta, infonde fiducia negli organismi regolatori, nei professionisti sanitari e negli utenti finali, garantendo che le prestazioni del IVD siano meticolosamente valutate e validate secondo i rigorosi requisiti dell'EU IVDR 2017/746.
Freyr offre un'assistenza completa per la preparazione di un solido rapporto di validità scientifica (SVR) per gli IVD, consentendovi di navigare con sicurezza nel panorama normativo e di introdurre sul mercato dispositivi IVD sicuri ed efficaci.
Rapporto di validità scientifica
- Piano di transizione per la conformità IVDR.
- Rapporto di validità scientifica (SVR) basato sulla letteratura e/o sui dati interni.
- Rapporti sulle prestazioni cliniche (RCP) basati sulla letteratura e/o sui dati interni.
- Rapporti analitici sulle prestazioni (APR)
- Prove cliniche o rapporti di valutazione delle prestazioni come da IVDR.
- Piano di valutazione delle prestazioni.
- Protocolli e rapporti di follow-up delle prestazioni post mercato (PMPF).
- Protocolli e rapporti di sorveglianza post-mercato (PMSR).
- Scrivere/revisionare altri documenti, come foglietto illustrativo/IFU, istruzioni di riferimento rapido (QRI), manuale operativo/utente, ecc.

- Garantire la conformità alle recenti normative applicabili.
- Team di esperti qualificati
- Soluzioni su misura per le vostre esigenze
- Gestione delle risorse normative/Servizi di incremento del personale
- Contributi interfunzionali da parte di esperti di dispositivi medici per soddisfare i requisiti.





