Servizi di etichettatura clinica - Panoramica
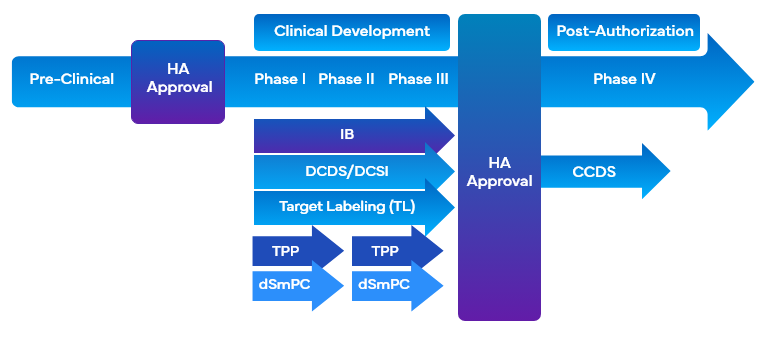
Durante lo sviluppo di un farmaco, le aziende utilizzano una serie di strumenti di etichettatura clinica che impiegano l'etichettatura target per facilitare lo sviluppo del farmaco. Questi strumenti allineano simultaneamente gli obiettivi di marketing e di etichettatura della sperimentazione clinica con il disegno del programma di sviluppo o dello studio e facilitano la stesura della panoramica clinicaCO). Alcuni degli strumenti di etichettatura clinica che utilizzano l'etichettatura target durante lo sviluppo dei farmaci sono:
- Opuscolo del ricercatoreIB)
- Etichettatura del bersaglioTL)/Profilo del bersaglio
- Scheda tecnica del nucleo di sviluppoDCDS)
- Sviluppo di informazioni di base sulla sicurezzaDCSI)
- Profilo del prodotto targetTPP) FDA
È importante che le aziende adottino un approccio modulare, raccogliendo le informazioni sulla sicurezza e sull'efficacia in diversi tipi di etichette cliniche per integrare i requisiti di etichettatura clinica. Ciò soddisferebbe l'esigenza di aiutare gli sperimentatori e gli sponsor in modo efficace, presentando e aggiornando una sezione DCSI mirata e dedicata, che può essere comodamente inserita in diverse categorie cliniche.
Inoltre, la DCSI è inclusa nella Company Core Safety InformationCCSI), che costituisce la base per la prima Company Core Data SheetCCDS) e viene utilizzata per l'ingresso del prodotto nel mercato. Per supportare la documentazione per i valutatori è necessaria anche la stesura di una CO accurata che comprenda la portata e le criticità del programma di sviluppo clinico del farmaco.
Servizi di etichettatura clinica di Freyr
Servizi di etichettatura clinica
- Creazione e revisione del fascicolo sperimentaleIB)
Freyr ha una notevole esperienza nella creazione, nella stesura e nella revisione delle IB per vari programmi in fase clinica dei nostri clienti. Gli IB sono le forme più recenti di etichette destinate a fornire allo sperimentatore o al medico curante informazioni rilevanti sul farmaco/intervento. Il loro scopo è quello di fornire agli sperimentatori e alle altre persone coinvolte nella sperimentazione le informazioni necessarie per facilitare la comprensione del razionale e il rispetto di molte caratteristiche chiave del protocollo. Queste includono la dose, la frequenza/intervallo della dose, i metodi di somministrazione e le procedure di monitoraggio della sicurezza. Il IB contiene informazioni precliniche e cliniche relative a un farmaco in sperimentazione.

Quando lavorano sugli IB, gli esperti di etichettatura clinica di Freyrpresentano le informazioni in forma concisa, semplice, obiettiva ed equilibrata. Le stesse qualità possono essere considerate anche nella traduzione dei documenti. Oltre alla stesura degli IB, Freyr supporta anche la revisione annuale degli IB e lavora alle revisioni necessarie, in conformità con le procedure standard stabilite dai clienti e dagli sponsor.
- Sviluppo dell'etichettatura del targetTL)/profilo del target
- Sviluppo e revisione di DCDS e DCSI
Freyr ha una comprovata esperienza nella creazione di schede di dati fondamentali per lo sviluppoDCDS) di alta qualità. La DCDS è un'etichetta di base intermedia fondamentale per ricavare i contenuti delle etichette nazionali first-to-file (come USPI, SmPC, ecc.). Il DCSI viene preparato a partire dall'etichetta target e fornisce sicurezza ed efficacia integrate a un intervento o a un farmaco. Il DCSI aiuta gli sperimentatori e gli sponsor presentando e aggiornando sezioni DCDS mirate e dedicate che possono essere comodamente collocate all'interno dell'IB. Il DCSI facilita lo sviluppo del CCSI, che in seguito costituisce parte integrante della Scheda tecnica di baseCCDS) della società.
- Sviluppo e revisione del profilo del prodotto targetTPP) FDA e del progetto SmPC dell'UE (dSmPC)
Il Target Product Profile (TPP)/bozza del Riassunto delle Caratteristiche del Prodotto (dSmPC) è una forma di etichetta clinica che facilita le discussioni tra le aziende farmaceutiche e le autorità sanitarie. Il TPP/dSmPC viene utilizzato durante tutto il processo di sviluppo del farmaco, dalle fasi di pre-domanda per un Nuovo Farmaco Sperimentale (IND) e di domanda per un Nuovo Farmaco Sperimentale (IND) dello sviluppo del farmaco, attraverso i programmi post-commercializzazione, per perseguire nuove indicazioni o altri cambiamenti sostanziali nell'etichettatura degli studi clinici. Le aziende farmaceutiche specificano i concetti di etichettatura che sono gli obiettivi del programma di sviluppo del farmaco sotto forma di TPP/dSmPC. Il TPP/dSmPC fornisce una dichiarazione dell'intento generale del programma di sviluppo del farmaco e fornisce informazioni sul farmaco in una particolare fase di sviluppo. Come partner normativo strategico, Freyr ha esperienza nella preparazione di TPP per gli US e dSmPC per l'UE.
- Risorse con approfondite conoscenze normative in materia di confezionamento ed etichettatura clinica
- Esperienza nel gestire con successo l'etichettatura dei farmaci a livello globale e regionale per i clienti di Fortune pharma negli USA, in Europa, APAC, MENA, ecc.
- Competenza normativa globale nell'aiutare le organizzazioni delle scienze della vita, ovvero produttori farmaceutici, biotecnologici e nutrizionali
- Medici scrittori altamente qualificati in possesso di un'ampia esperienza di etichettatura regolatoria
- Conoscenza approfondita e aggiornata delle modifiche all'etichettatura dei farmaci a livello globale da parte di diverse autorità sanitarie, quali USFDA, EMA, TGA, ecc.
- Team dedicato alla conformità che segue lo stato dell'implementazione della scheda dati di base e della scheda dati di base aziendaleCDSCCDS) nei marchi regionali
- Competenza nell'etichettatura degli studi clinici e nei servizi di etichettatura clinica
- Professionisti di grande esperienza nel settore farmaceutico, biotecnologico e dell'etichettatura nutrizionale





