Panoramica sull'approvazione pre-commercializzazione dei dispositivi medici da parte USFDA
Il processo di approvazione USFDA (PMA) USFDA è uno dei percorsi di registrazione dei dispositivi forniti dallaFDA US , progettato principalmente per i dispositivi medici FDA III FDA . Il processo di approvazione FDA per i dispositivi di classe III comporta meticolose valutazioni scientifiche e normative per valutare la sicurezza e l'efficacia del dispositivo medico, garantendo il rispetto dei più elevati standard prima dell'autorizzazione alla commercializzazione.
Prenotate un incontro con i nostri esperti di approvazione premarket
Who deve presentare una domanda di approvazione pre-commercializzazione (PMA) per dispositivi medici all USFDA ?
I produttori di dispositivi devono presentare una domanda PMA se il dispositivo:
- È un romanzo.
- Appartiene a una classe ad alto rischio.
- Non si trova nel database della classificazione dei prodotti.
- Non è sostanzialmente equivalente (NSE) ai dispositivi di Classe I, II o III.
Ottenete la consulenza di esperti per la vostra domanda di approvazione pre-market
Qual è la differenza tra le domande 510(k), PMA e De-Novo?
Approvazione pre-commercializzazione
- Dispositivo appartenente alla Classe III che supporta la vita umana o che presenta un rischio potenziale e irragionevole di malattia o lesione.
- Il processo di approvazione FDA PMA richiede studi clinici.
- Richiede un'ispezione in loco prima di rilasciare l'approvazione PMA.
- 180 giorni di calendario
Classificazione De-Novo
- Dispositivi nuovi di Classe I e II che non hanno un dispositivo di riferimento valido.
- Richiede dati di studi clinici.
- Nessun audit in loco prima dell'approvazione di De-Novo.
- 150 giorni di calendario.
Registrazione 510(k)
- Dispositivi di classe III FDA che presentano un'equivalenza sostanziale con il dispositivo di riferimento.
- Non richiede test sull'uomo.
- Nessuna verifica in loco prima dell'autorizzazione 510(k).
- 90 giorni di calendario.
Quali sono i diversi metodi di richiesta di approvazione pre-market FDA ?
I produttori possono optare per uno dei seguenti quattro metodi di domanda PMA che meglio si adatta al loro dispositivo:
- PMA tradizionale
- PMA modulare
- Protocollo di sviluppo del prodotto
- Esenzione per i dispositivi umanitari
Quali sono i requisiti dei dati per l'approvazione pre-market dei dispositivi medici?
Secondo il 21 CFR parte 814, i richiedenti devono presentare un modulo di domanda CDRH debitamente compilato, gli impegni richiesti e un fascicolo tecnico PMA ben redatto alla US FDA. Il fascicolo tecnico dovrà includere i dati non clinici e clinici.
Dati non clinici - Si tratta di dati relativi a microbiologia, tossicologia, immunologia, biocompatibilità, stress, usura, durata di conservazione e altri test di laboratorio o su animali.
Dati clinici - Consistono in dati sui protocolli di studio, dati sulla sicurezza e sull'efficacia, reazioni avverse e complicazioni, guasti e sostituzioni dei dispositivi, informazioni sui pazienti, reclami dei pazienti, tabulati dei dati di tutti i singoli soggetti, risultati delle analisi statistiche e qualsiasi altra informazione sulle indagini cliniche.
Qual è il processo di richiesta della PMA?
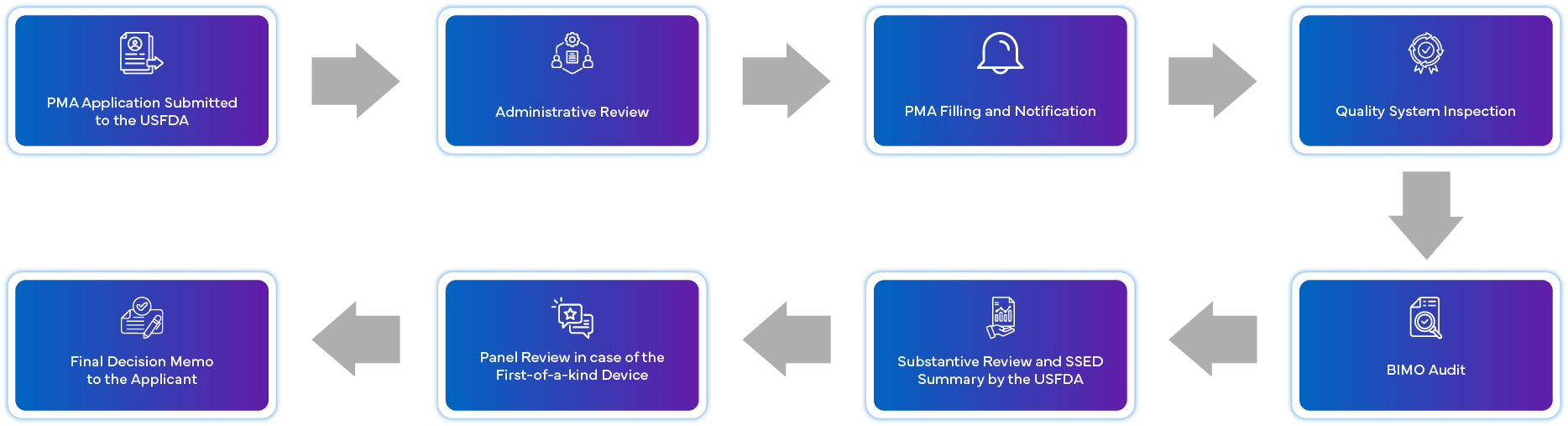
Quali sono i requisiti di conformità post-approvazione per la PMA?
I dispositivi approvati secondo il percorso PMA devono essere conformi ai requisiti post-marketing stabiliti dall'USFDA. Il dispositivo deve essere conforme a quanto segue:
- Requisiti post-approvazione imposti nell'ordine di approvazione PMA dell FDA .
- Gestione delle modifiche post-approvazioneattraverso la presentazione tempestiva dei relativi supplementi alla PMA.
- Presentazione di relazioni post-approvazione (annuali)
- Regolamenti 21 CFR 803 per la segnalazione dei dispositivi medici (MDR)
- Studi di sorveglianza post-market comerichiesto dall USFDA negli ordini di approvazione della PMA.
Quali sono le tariffe USFDA per la revisione della domanda di PMA?
Le tariffe MDUFA per la PMA originale e per i supplementi sono le seguenti...
| Tipo di applicazione | Tasse per l'anno fiscale 2023 (dal sup ottobre | |
|---|---|---|
| Tariffa standard | Tassa per le piccole imprese | |
| PMA, PDP, PMR, BLA | $441,547 |
|
| Supplemento Panel-Track | $353,238 | $88,309 |
| Supplemento di 180 giorni | $66,232 | $16,558 |
| Tassa annuale per i rapporti periodici su un dispositivo di Classe III (PMA, PDP e PMR) | $15,454 | $3,864 |
| Avviso di 30 giorni | $7,065 | $3,532 |
| Supplemento in tempo reale | $30,908 | $7,727 |
Grazie all'esperienza nella gestione delle richieste di PMA, Freyr può assistere nell'identificazione e nella compilazione delle informazioni e nella preparazione e revisione della domanda.
Competenze e vantaggi dellUSFDA per l'approvazione pre-commercializzazione dei dispositivi medici
- Due diligence normativa
- Conformità delle ispezioni del sistema qualità
- Conformità all'audit BIMO
- Compilazione del fascicolo tecnico PMA
- Pubblicazione e creazione di copie elettroniche
- Convalida e invio della copia elettronica
- Risponde alle risposte e alle carenze dell'ACR
- Servizi di collegamento fino all'approvazione pre-commercializzazione FDA
- Consultazione per le carenze
- Elenco dei dispositivi e registrazione degli stabilimenti
- Gestione dei supplementi PMA e degli avvisi di 30 giorni
- Presentazione dei rapporti periodici annuali
- Audit simulati e 21 CFR 820 Formazione

- Esperienza nella gestione di numerose richieste di PMA FDA per diverse categorie di dispositivi.
- Un team di esperti per la richiesta di approvazione premarket FDA in base ai requisiti normativi.
- Supporto aggiuntivo per la gestione delle domande relative alla PMA.
- Presentazione puntuale dei risultati
- Aggiornato con leFDA modificheFDA US
