
Nel mondo in continua evoluzione dei dispositivi medici, la conformità non è un compito da svolgere una volta sola, ma un impegno costante. Il monitoraggio continuo e l'aggiornamento di rapporti chiave come i Rapporti di valutazione clinica (CER), i Rapporti di valutazione delle prestazioni (PER) e i Rapporti periodici di aggiornamento sulla sicurezza (PSUR) sono fondamentali durante l'intero ciclo di vita di un dispositivo medico, dalla ricerca iniziale alla sorveglianza post-vendita. Con la continua evoluzione del panorama dei progressi in campo medico e dei requisiti normativi, garantire la sicurezza e la conformità dei dispositivi medici e degli IVD attraverso una redazione medica efficace continua a essere la pietra miliare del successo e della redditività a lungo termine.
Vediamo come la gestione del ciclo di vita rimane essenziale per il successo di un dispositivo medico.
Il lancio di un dispositivo medico è il culmine di anni di sforzi spesi in diverse fasi come la ricerca, lo sviluppo, gli studi clinici, la presentazione delle domande di autorizzazione e la sorveglianza post-vendita. Questo processo si estende per molti anni e ogni fase accumula dati vitali in grande quantità, che devono essere accuratamente compilati e analizzati per garantire che il dispositivo rimanga sicuro.
La conformità non è un evento una tantum, e una gestione efficace del ciclo di vita aiuta a evitare ritardi che potrebbero essere costosi in seguito. Questi ritardi spesso si verificano a causa di una pianificazione inefficace per cambiamenti normativi imprevisti o non conformità, che potrebbero essere stati trascurati. Aggiornamenti regolari di documenti critici come CER, PER e PSUR garantiscono che i produttori soddisfino i requisiti normativi in evoluzione e mantengano la sicurezza del prodotto. La gestione del ciclo di vita assicura che i produttori, fin dall'inizio, abbiano pianificato ogni fase, e quindi possano evitare insidie e garantire un ingresso di successo sul mercato e la longevità dei loro dispositivi.
Siete al passo con la conformità?
Dalle bende agli impianti, l'industria dei dispositivi medici è un settore all'avanguardia e creativo con una ricchezza di prospettive. Nonostante il forte desiderio dei produttori di fornire al mercato prodotti sicuri e di alta qualità, l'ambiguità persiste. L'EU MDR ha sostituito la Direttiva sui Dispositivi Medici (MDD) e la Direttiva sui Dispositivi Medici Impiantabili Attivi (AIMDD). Questa regolamentazione è stata attuata per imporre controlli più rigorosi, migliorare la sicurezza dei pazienti e promuovere una maggiore trasparenza nel settore sanitario. C'è molta incertezza riguardo a tali standard e le questioni cruciali di conformità sono spesso trascurate. Tuttavia, i produttori di dispositivi medici dovrebbero adottare misure per evitare difficoltà normative.
Indaghiamo le sfide più comuni affrontate dai produttori di dispositivi medici.
- Mantenimento delle CAPA (Corrective and Preventive Action)
- Rispetto delle procedure di reclamo
- Seguire le procedure di vigilanza
- Valutazione clinica e sorveglianza post-commercializzazione
- Collegamento con gli organismi notificati
Le migliori pratiche per rimanere conformi
Per superare queste sfide, noi di Freyr abbiamo creato
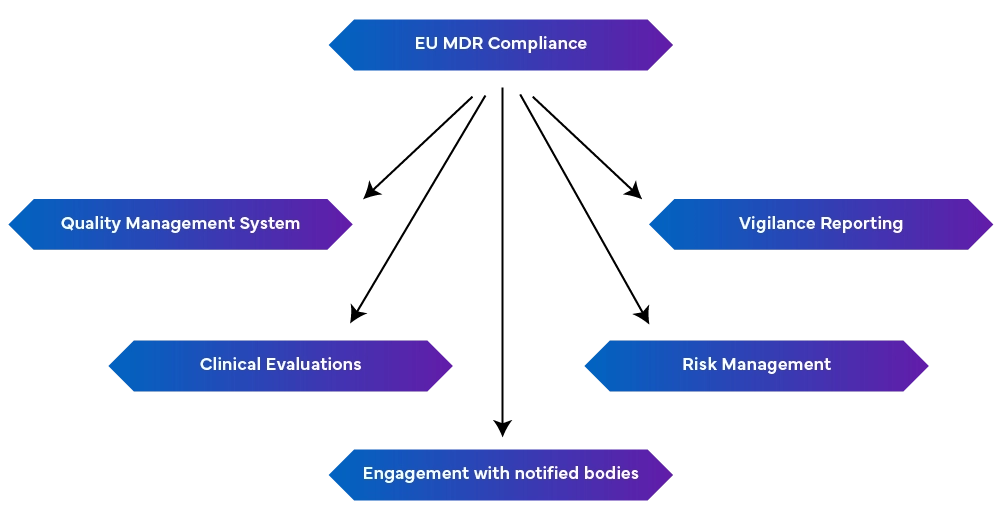
-Unsolido sistema di gestione della qualità (EN ISO 13485:2016): Include gli aspetti produttivi, tra cui la conformità normativa, la documentazione tecnica, le dichiarazioni di conformità UE e la gestione del rischio.
-Segnalazione di vigilanza: Mantenere la segnalazione di vigilanza come un processo continuo, piuttosto che come uno sforzo singolo.
- Gestione proattiva dei rischi: Identifica e riduce i rischi durante l'intero ciclo di vita del dispositivo, aggiornandosi regolarmente per affrontare i rischi emergenti.
- Condurre valutazioni cliniche e sorveglianza post-vendita: Si tratta di dimostrare la sicurezza e le prestazioni del dispositivo utilizzando dati clinici. Se necessario, devono essere eseguite indagini cliniche e le valutazioni cliniche devono essere regolarmente aggiornate con i dati di sorveglianza post-vendita. Sono inoltre richiesti rapporti periodici di aggiornamento sulla sicurezza che riassumano i risultati.
- Collegamento con gli Organismi Notificati: Le modifiche alle normative possono influire sui requisiti MDR, per cui è fondamentale mantenere un buon rapporto con gli organismi notificati per ottenere aggiornamenti e modifiche tempestivi.
Come può aiutarvi un esperto di regolamentazione
Cercare di stare al passo con un panorama normativo in continua evoluzione può essere difficile. Allora perché non lasciarsi guidare da un esperto in questo labirinto? La gestione dei requisiti normativi del ciclo di vita di un dispositivo medico non è solo complessa, ma richiede anche molte risorse. Nel caso delle aziende più piccole, dove le risorse interne possono essere utilizzate meglio in altre aree, l'aiuto di un partner regolatorio esterno può rivelarsi indispensabile. Questi offrono una conoscenza specialistica delle normative in evoluzione e assicurano che i vostri rapporti chiave, come i CER, i PER e i PSUR, siano costantemente aggiornati e conformi.
Potete evitare costosi ritardi, prevenire la non conformità e snellire il processo di approvazione. Inoltre, un esperto di regolamentazione può offrire soluzioni personalizzate in base alle esigenze specifiche del vostro dispositivo, garantendo che la sorveglianza post-market, l'analisi delle lacune e tutta la documentazione di conformità siano aggiornate. Il loro coinvolgimento può semplificare l'intero processo, ridurre al minimo i rischi e garantire che il dispositivo sia in grado di soddisfare le aspettative di sicurezza e prestazioni.
Freyr può aiutarvi a soddisfare tutte le vostre esigenze normative in materia di gestione del ciclo di vita. us oggi stesso!









