Mentre i prodotti innovativi o di marca comportano costi aggiuntivi legati alla ricerca e allo sviluppo del prodotto, dalla fase di identificazione della molecola all'autorizzazione post-commercializzazione, i farmaci generici sono relativamente convenienti. Queste terapie non solo riducono il costo complessivo del trattamento, ma migliorano anche in modo significativo l'accesso dei pazienti a farmaci salvavita. Poiché la dipendenza dall'importazione di antibiotici generici e di farmaci per il trattamento di malattie rare ha influito sulla disponibilità di questi farmaci a livello globale durante la pandemia, le agenzie sanitarie stanno introducendo nuove linee guida per sostenere produttori locali di farmaci.
Dal 1993, l'organizzazione commerciale Medicines for Europe, precedentemente nota come European Generics Medicine Association (EGA), è stata coerente con il suo obiettivo di familiarizzare la terapia economicamente vantaggiosa alla popolazione europea di pazienti. Nell'ultimo decennio, hanno fornito con successo il 67% di tutti i medicinali all'Europa, ampliando l'accesso dei pazienti al 100% in sette aree terapeutiche chiave. Nell'ambito delle autorità sanitarie europee, un'“autonomia strategica” post-Brexit ha messo in moto un'esigenza immediata per rimediare efficacemente allo svantaggio competitivo affrontato dai produttori europei di generici e biosimilari. Con l'avvento della pandemia di COVID-19, le capacità della catena di approvvigionamento globale hanno ceduto sotto la pressione della domanda di farmaci. Farmaci salvavita che fornivano sollievo da malattie croniche sono scomparsi dagli scaffali delle farmacie locali. Per superare gli ostacoli relativi ai prodotti farmaceutici protetti da brevetto e costruire capacità di produzione locale di farmaci per migliorare l'accesso dei pazienti, il Consiglio dell'UE ha adottato un regolamento che prevede un'eccezione a una molecola originale fornendo un Certificato di Protezione Complementare (SPC). La disposizione facilita la produzione di generici e biosimilari prima della scadenza del brevetto a fini di stoccaggio o esportazione. Tuttavia, l'eccezione sarà applicabile solo nelle seguenti circostanze.
- I generici o i biosimilari prodotti sono destinati esclusivamente all'esportazione in un altro Paese in cui il brevetto per la molecola del farmaco non esiste o è scaduto, o a scopi di stoccaggio entro il periodo di validità del brevetto di sei (06) mesi.
- Come richiesto, il produttore ha trasmesso l'informazione all'Autorità Sanitaria Locale e al titolare del CPS prima di tre (03) mesi.
- Il produttore ha informato tutte le parti interessate alla commercializzazione del prodotto.
- Il produttore si è assicurato che i requisiti di etichettatura indichino che il prodotto farmaceutico è destinato esclusivamente all'esportazione.
In effetti
Dopo la concessione dell'autorizzazione condizionata all'immissione in commercio del vaccino COVID-19 nell'UE, il Comitato per i Medicinali per Uso Umano dell'Agenzia Europea per i Medicinali (CHMP) ha autorizzato quattro (04) siti per la produzione del vaccino nell'arco di un anno: due (02) in Svizzera e due (02) negli Stati Uniti. Queste decisioni a favore dell'espansione dei siti di produzione miglioreranno le capacità di produzione dei vaccini, rendendoli più accessibili alla popolazione europea.
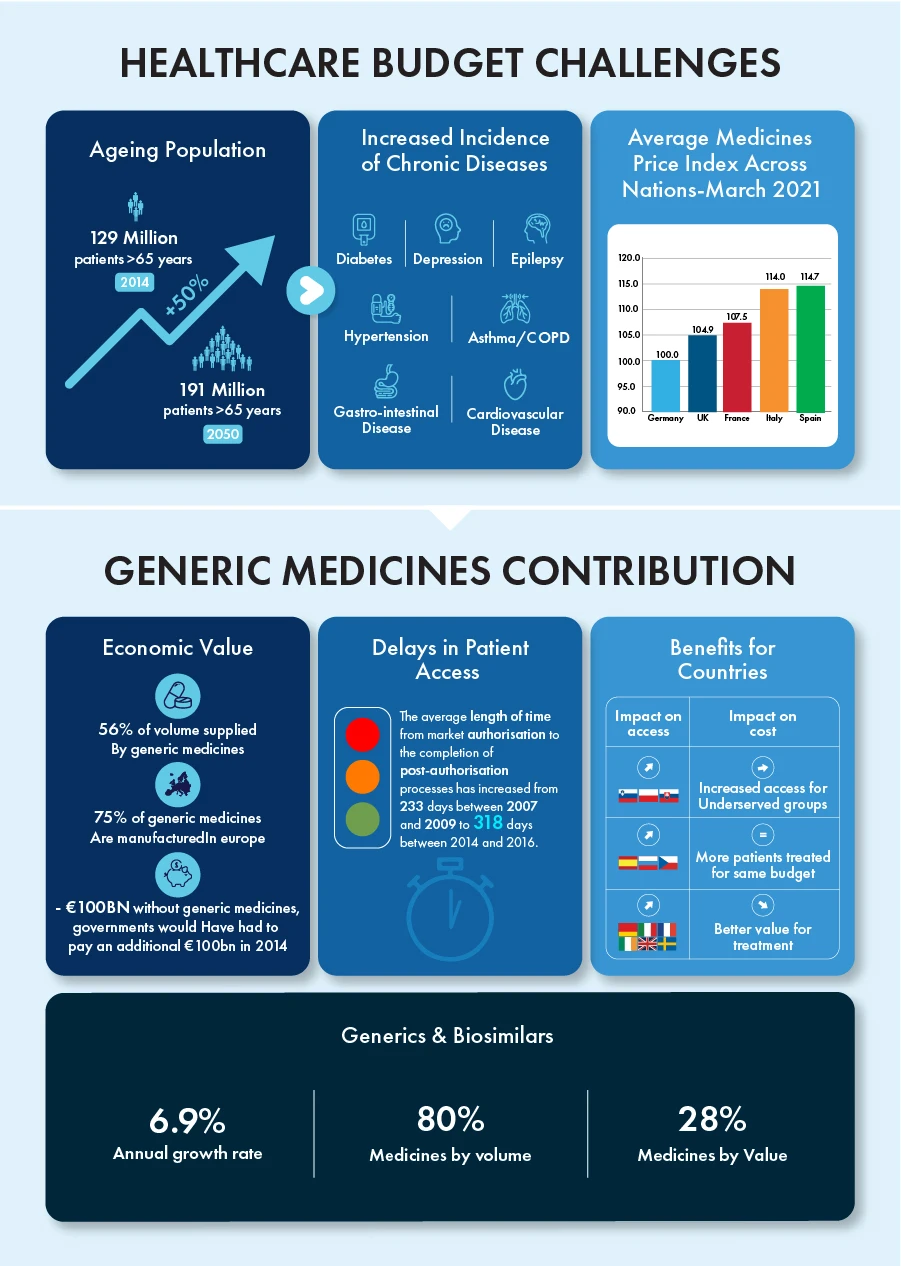
I generici e i biosimilari hanno contribuito da soli a un tasso di crescita annuale del 6,9%, rappresentando l'80% di tutti i farmaci in volume e il 28% in valore nell'ultimo decennio. La scadenza del brevetto di alcuni farmaci biologici, per un valore di circa 90 miliardi di euro, è prevista per il 2023, creando un ambiente competitivo per questi prodotti con un enorme potenziale di crescita.
L'attuazione di un'esenzione dal brevetto SPC apporterebbe all'Unione europea i seguenti vantaggi:
- Aggiungendo altri 90,5 miliardi di euro circa all'anno.
- Creazione di venticinquemila (25.000) nuove opportunità di lavoro, di cui duemila (2.000) dirette, per il settore API dell'UE. L'iniziativa consentirà member states dell'UE member states 3,1 miliardi di euro in spese sanitarie.
- Stoccaggio di alternative più economiche di farmaci innovativi brevettati per consentirne l'ingresso sul mercato subito dopo la scadenza della Proprietà Intellettuale (PI), migliorando l'accesso dei pazienti.
Per un produttore farmaceutico con sede al di fuori dell'Unione Europea, l'attuazione della deroga SPC è una delle iniziative più vantaggiose a favore dei farmaci generici. Poiché l'Autorità sanitaria dell'UE regola i medicinali per uso umano e veterinario attraverso una procedura centralizzata o decentralizzata, districarsi tra i requisiti locali specifici può diventare un compito arduo. Un esperto, consapevole dei requisiti locali relativi alle varie richieste e ai documenti di licenza, può aiutarti a concentrare i tuoi sforzi sui protocolli di produzione essenziali piuttosto che fissarti su complessi ostacoli normativi. Reinventa il potenziale della tua attività sperimentando la conformità e la qualità. Contatta Freyr.









