La scrittura regolatoria svolge un ruolo cruciale nell'industria farmaceutica e sanitaria, facendo da ponte tra le complesse informazioni scientifiche e i vari interlocutori. L'arte di adattare la scrittura regolatoria ai diversi destinatari è essenziale per una comunicazione efficace e per la conformità. Questo blog analizza come adattare la scrittura regolatoria a tre (3) destinatari chiave: pazienti, medici e autorità di regolamentazione.
Capire l'importanza di una scrittura specifica per il pubblico
La scrittura normativa comprende vari documenti, ognuno dei quali ha uno scopo specifico e si rivolge a lettori diversi. La capacità di adattare i contenuti a questi diversi destinatari è fondamentale per garantire che le informazioni siano accurate ma anche accessibili e fruibili.
Puntatori primari che considerano l'approccio tailoring:
Scrivere per i pazienti: Semplificare le informazioni complesse
Quando si redigono i documenti regolatori per i pazienti, l'obiettivo principale è trasmettere le informazioni essenziali in modo chiaro e comprensibile senza sacrificare l'accuratezza.
- Uso del linguaggio semplice
Utilizzate parole di uso quotidiano ed evitate il gergo tecnico. Quando i termini medici sono necessari, fornire spiegazioni chiare.
- Ausili visivi e formattazione
Incorporate diagrammi, grafici e infografiche per illustrare concetti complessi. Utilizzate punti elenco, titoli e paragrafi brevi per migliorare la leggibilità.
- Affrontare le preoccupazioni più comuni
Anticipare e rispondere alle potenziali domande o preoccupazioni che i pazienti potrebbero avere riguardo al farmaco o al trattamento.
Esempio: Foglietti informativi per i pazienti
Questi documenti devono:

Scrivere per i clinici: Bilanciare dettaglio e praticità
I medici hanno bisogno di informazioni complete ma concise per prendere decisioni informate sulla cura dei pazienti. La scrittura normativa per questo pubblico deve bilanciare i dettagli scientifici e l'applicabilità pratica.
- Enfasi sulla rilevanza clinica
Concentrarsi sulle informazioni che hanno un impatto sulla cura del paziente, come le linee guida per il dosaggio, le controindicazioni e le interazioni tra farmaci.
- Presentazione strutturata dei dati
Organizzare i risultati degli studi clinici e i dati sulla sicurezza in un formato logico e facile da navigare. Utilizzate tabelle e grafici per riassumere i risultati principali.
- Inclusione di raccomandazioni basate sull'evidenza
Fornire una guida chiara e basata sull'evidenza sull'uso appropriato di farmaci o dispositivi medici in vari scenari clinici.
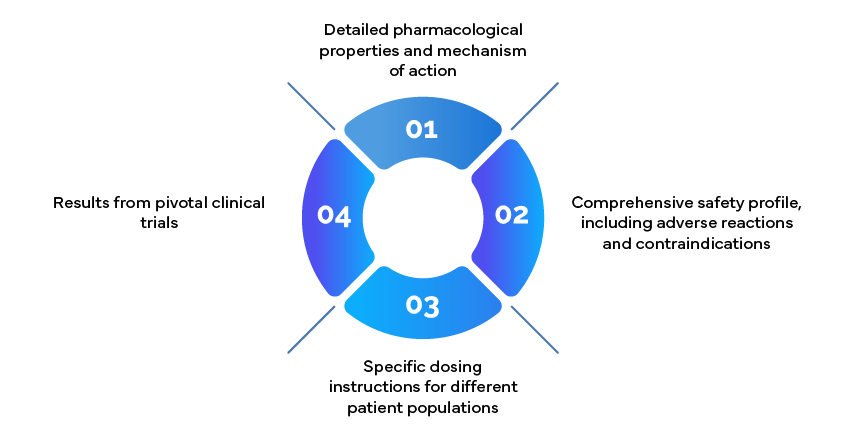
Esempio: Informazioni di prescrizione
I documenti informativi per la prescrizione, noti anche come foglietti illustrativi, sono risorse fondamentali per i medici. Dovrebbero includere:
Scrivere per le autorità di regolamentazione: Precisione e conformità
Le agenzie regolatorie richiedono una documentazione esaustiva e scientificamente rigorosa per valutare la sicurezza e l'efficacia dei nuovi prodotti. Scrivere per questo pubblico richiede un'attenzione meticolosa ai dettagli e un'aderenza rigorosa alle linee guida normative.
- Aderenza alle linee guida normative
Assicurarsi che tutti i documenti siano conformi ai requisiti specifici in materia di formato e contenuto previsti dagli organismi di regolamentazione quali la FDA EMA.
- Presentazione completa dei dati
Fornire un'analisi approfondita di tutti i dati rilevanti, comprese descrizioni dettagliate delle metodologie di studio, delle analisi statistiche e dell'interpretazione dei risultati.
- Trasparenza nella rendicontazione
Indicare eventuali limitazioni o potenziali pregiudizi nella ricerca e spiegare in che modo questi fattori possono influire sulle conclusioni.
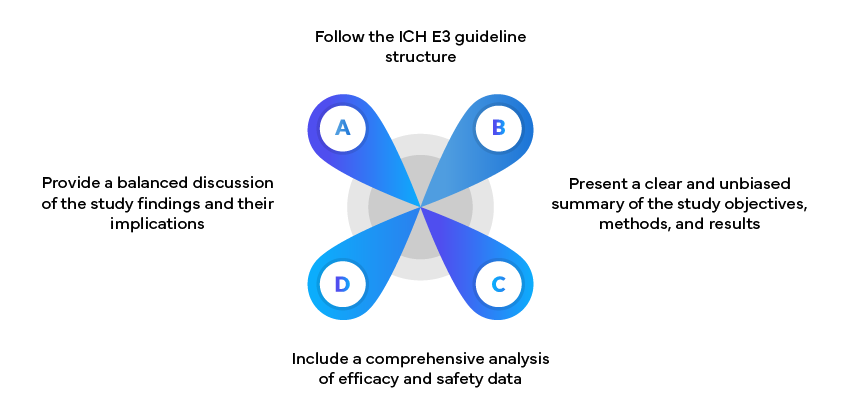
Esempio: Rapporti di studi clinici
I rapporti sugli studi clinici (CSR) sono documenti fondamentali per la presentazione delle domande regolatorie. Essi devono:
Conclusione
Adattare la scrittura regolatoria a diversi tipi di pubblico è un compito complesso ma essenziale nel settore farmaceutico e sanitario. Adattando i contenuti e gli stili di presentazione alle esigenze specifiche dei pazienti, dei medici e degli enti regolatori, gli autori possono garantire che le informazioni critiche siano comunicate e comprese in modo efficace.
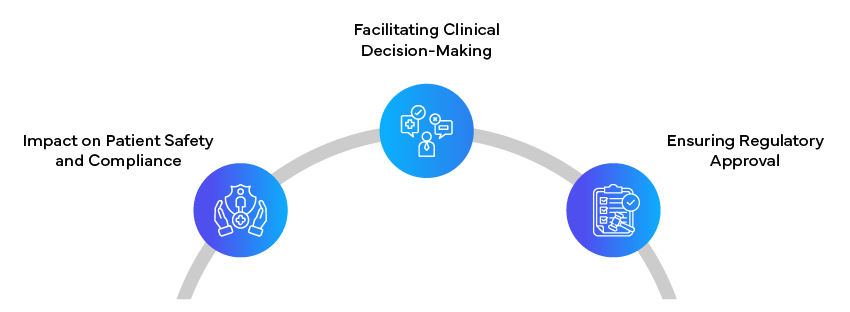
La capacità di redigere documenti regolatori chiari, accurati e adatti al pubblico non è solo una questione di conformità; ha un impatto diretto sulla sicurezza dei pazienti, sul processo decisionale clinico e sul successo dello sviluppo e della commercializzazione di nuovi prodotti sanitari. Con la continua evoluzione del panorama regolatorio, l'importanza di una scrittura regolatoria competente, in grado di colmare il divario tra i dati scientifici complessi e le diverse esigenze degli stakeholder, è destinata a crescere. I redattori di testi regolatori svolgono un ruolo cruciale nel promuovere la salute pubblica e l'innovazione in campo medico, concentrandosi sulla chiarezza per il paziente, sulla rilevanza clinica per gli operatori sanitari e sulla precisione globale per gli enti regolatori. Padroneggiare l'arte della scrittura regolatoria specifica per il pubblico è quindi un'abilità inestimabile nell'ambiente sanitario odierno in rapida evoluzione.









