
Panoramica sulla registrazione dei dispositivi medici a Taiwan
Taiwan ha una crescente domanda di Dispositivi Medici. La Taiwan Food & Drug Administration (TFDA), sotto il Ministero della Salute e del Benessere (MOHW), regola i Dispositivi Medici attraverso la Legge sugli Affari Farmaceutici (PAA). I produttori stranieri senza un ufficio fisico a Taiwan richiedono la rappresentanza di un agente a Taiwan come prerequisito per il processo di registrazione dei Dispositivi Medici a Taiwan.
Autorità di regolamentazione: Taiwan Food and Drug Administration
Regolamento: Legge sugli affari farmaceutici (PAA) e regolamento per la registrazione dei dispositivi medici
Rappresentante autorizzato: È richiesta la rappresentanza di un agente di Taiwan
Requisito del SGQ: Documentazione del sistema qualità (QSD) ISO 13485
Valutazione dei dati tecnicia: Divisione Dispositivi Medici e Cosmetici
Validità della licenza: QSD - 3 anni; registrazione del prodotto - 5 anni
Requisiti di etichettatura: Articolo 75, Legge sugli affari farmaceutici
Formato di presentazione: Carta
Lingua: Inglese e cinese
Classificazione dei dispositivi medici di Taiwan
La TFDA classifica i dispositivi medici in 3 classi in base al rischio: Classe I per i dispositivi a basso rischio, Classe II per i dispositivi a rischio moderato e Classe III per i dispositivi ad alto rischio. La necessità di un dispositivo predicato rappresenta una sfida per l'ingresso sul mercato di nuovi dispositivi. Un'altra complessità è rappresentata dall'aumento dei tempi procedurali per i dispositivi di Classe II e III che necessitano di una documentazione del sistema di qualità. Tutti i dispositivi medici importati devono ottenere un certificato di registrazione dalla TFDA.
| Classe del dispositivo | Il rischio |
|---|---|
| Classe I | Basso rischio |
| Classe II | Rischio moderato |
| Classe III | Alto rischio |
Rappresentanza di agenti a Taiwan
I produttori stranieri senza un ufficio fisico a Taiwan dovrebbero nominare un Agente di Taiwan come prerequisito per commercializzare dispositivi a Taiwan. Nominare un'organizzazione terza come Agente di Taiwan invece di un distributore offre la flessibilità di esplorare più distributori per una migliore penetrazione del mercato. L'Agente di Taiwan deve avere un'entità legale stabilita a Taiwan, certificata con una Licenza di Vendita Farmaceutica.
Registrazione dei dispositivi medici a Taiwan
Prima che un dispositivo medico possa essere venduto a Taiwan, è necessaria la registrazione della documentazione del sistema di qualità (QSD) per l'impianto di produzione, oltre alla registrazione del dispositivo medico. La registrazione QSD è esente solo per i dispositivi medici di Classe I (non sterili). La licenza QSD (ottenuta dopo l'approvazione della registrazione QSD) a Taiwan è simile alle buone pratiche di fabbricazione (GMP) per i dispositivi medici.
TFDA ha annunciato che, a partire dal 1° giugno 2022, i titolari di licenza di dispositivi medici di Classe III sono tenuti a caricare l'UDI e le relative informazioni sul prodotto nel database UDI (UDID). I produttori di dispositivi medici sono inoltre tenuti a posizionare l'UDI sull'etichetta del prodotto. Inoltre, a partire dal 1° giugno 2023, i dispositivi medici di Classe II sono tenuti a rispettare le normative pertinenti relative all'UDI.
Flusso di processo
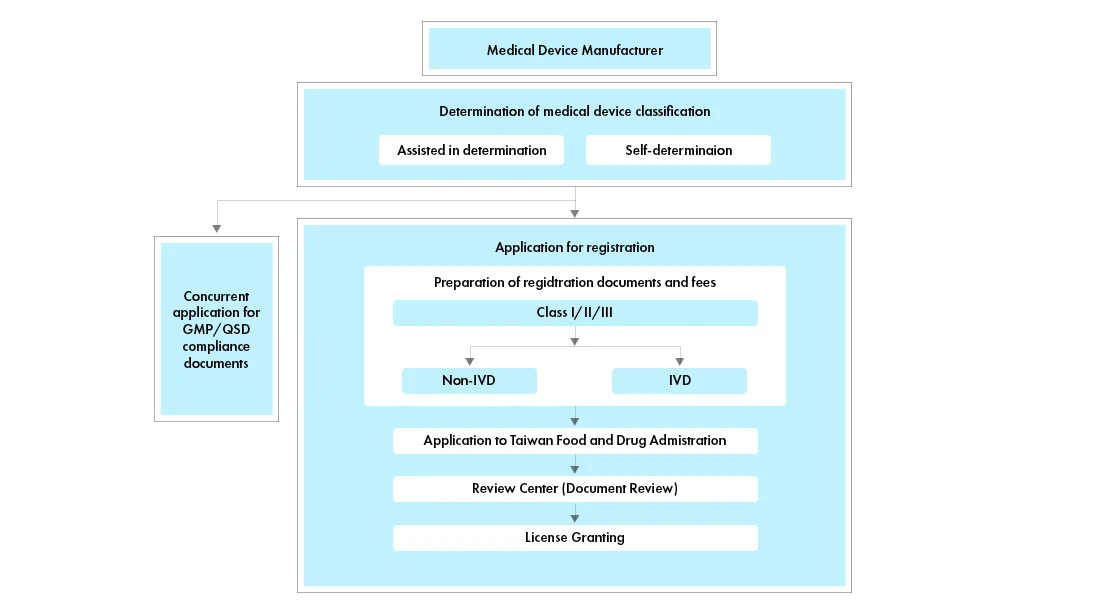
Gestione del ciclo di vita dei dispositivi medici dopo l'approvazione
Freyr supporta i produttori esteri nella gestione End-to-End del ciclo di vita dei dispositivi medici, incluse le attività post-approvazione, come:
- Gestione delle modifiche post-approvazione - modifiche alle approvazioni dei dispositivi medici esistenti, come l'aggiunta di nuove varianti e accessori, l'aggiunta di nuove indicazioni d'uso, ecc.
- Mantenimento delle approvazioni e della registrazione attraverso il pagamento puntuale delle tasse amministrative e di registrazione.
- Rinnovo delle licenze
- Collegamento tra la TFDA e il produttore
- Gestione delle importazioni
Freyr è specializzata nel soddisfare le esigenze normative dei dispositivi medici a Taiwan. Grazie a un'ampia rete, Freyr aiuta a nominare un agente locale affidabile, la cui presenza è di estrema importanza per tutta la durata della sorveglianza post-marketing. I nostri esperti assistono anche nella selezione del dispositivo di riferimento e delle approvazioni esistenti in altri mercati per supportare l'ingresso nel mercato di un nuovo dispositivo.
Sintesi
| Classe del dispositivo | Criteri di rischio/classificazione | SGQ | Registrazione del prodotto |
|---|---|---|---|
| Classe I | Basso rischio | Esenti (dispositivi non sterili di Classe I) | Sì |
| Classe II | Rischio moderato | QSD | Sì |
| Classe III | Alto rischio | QSD | Sì |
Competenza di Freyr
- Due diligence normativa
- Classificazione ufficiale
- Approvazioni QSD
- Registrazione del dispositivo
- Rappresentante legale
- Supporto per l'etichettatura
- Supporto alla traduzione
- Identificazione e qualificazione dei distributori
- Sorveglianza post marketing
- Gestione delle modifiche successive all'approvazione
- Rinnovo e trasferimento della licenza
- Presentazione e collegamento

