
Panoramica sulla registrazione dei dispositivi medici in Vietnam
Il mercato dei dispositivi medici del Vietnam è in crescita ed è attualmente uno dei settori in espansione nel paese. I dispositivi medici nel paese sono regolamentati dal Dipartimento delle Attrezzature Mediche e dei Lavori Sanitari (DMEHW) sotto il Ministero della Salute. I produttori stranieri devono nominare un Rappresentante Autorizzato Locale in Vietnam per assisterli nel processo di registrazione dei dispositivi medici in Vietnam.
Autorità di regolamentazione: Dipartimento delle attrezzature mediche e delle opere sanitarie (DMEHW)
Regolamento: Decreto n. 98/2021/ CP
Rappresentante autorizzato: Vietnam Rappresentante locale autorizzato
Requisito del SGQ: ISO 13485:2016
Valutazione dei dati tecnici: Dipartimento delle attrezzature mediche e delle costruzioni (DMEC) del Ministero della Salute.
Requisiti di Labelling: Decreto n. 111/2021
Formato di presentazione: In linea- Tempi: 15-60 giorni
Lingua: Inglese e vietnamita
Classificazione dei dispositivi medici in Vietnam
I dispositivi sono classificati in 4 classi (A, B, C e D), a loro volta suddivise in due gruppi, il gruppo 1 (Classe A) e il gruppo 2 (Classe B, C e D). La classificazione formale è disponibile presso il Department of Medical Equipment and Health Works (DMEHW) del Vietnam.
| Gruppo | Classe | Il rischio |
|---|---|---|
Gruppo 1 | Classe A | Livello basso |
Gruppo 2 | Classe B | Livello medio di rischio più basso |
Classe C | Livello medio superiore di rischio | |
Classe D | Alto livello di rischio |
Vietnam Rappresentante locale autorizzato
La nomina di un agente vietnamita affidabile e competente per i produttori stranieri è cruciale, in quanto devono farsi carico dei servizi di garanzia offerti dal produttore come parte della vendita del dispositivo. La traduzione in vietnamita è un requisito fondamentale per entrare nella regione, il che può essere effettivamente impegnativo nella pratica.
Freyr offre un supporto normativo che copre l'intera gamma di attività, come l'ottenimento del numero di riconoscimento di libera vendita per l'approvazione dei dispositivi medici da parte delle autorità. Forniamo inoltre un supporto linguistico esperto per mantenere intatta la prospettiva normativa della traduzione. Ci occupiamo delle esigenze post-approvazione dei clienti per mantenere la conformità durante l'intero ciclo di vita del prodotto in Vietnam.
Registrazione dei dispositivi medici in Vietnam
Tutti i prodotti di classe A e B richiedono una licenza di autorizzazione al commercio (MA). I dispositivi di classe A e B saranno sottoposti a una rapida revisione amministrativa da parte del Dipartimento della Salute della provincia in cui si trova il titolare della registrazione.
I dispositivi di classe C e D dovranno ora richiedere una licenza di autorizzazione al commercio (MA). Le licenze MA rimarranno valide a tempo indeterminato.
Flusso di processo
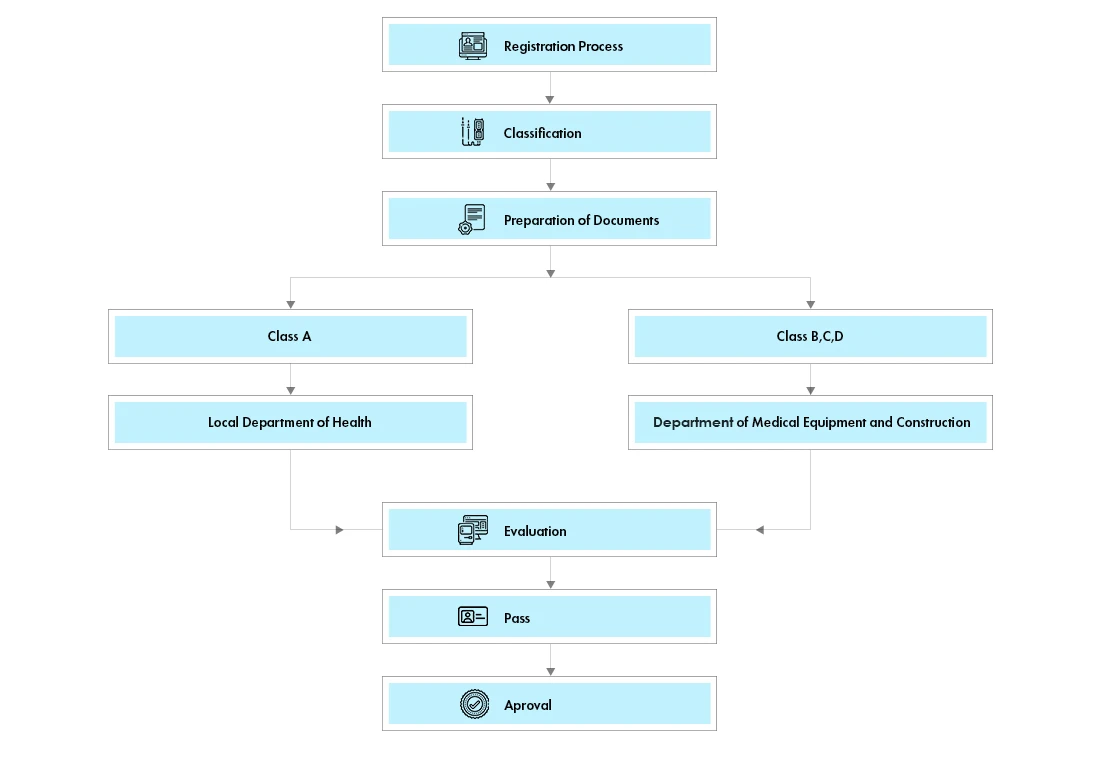
Gestione del ciclo di vita del dispositivo dopo l'approvazione
Freyr supporta i produttori esteri nella gestione End-to-End del ciclo di vita dei dispositivi medici, incluse le attività post-approvazione, come:
- Gestione delle modifiche post-approvazione - modifiche alle approvazioni dei dispositivi medici esistenti, come l'aggiunta di nuove varianti e accessori, l'aggiunta di nuove indicazioni d'uso, ecc.
- Mantenimento delle approvazioni e della registrazione attraverso il pagamento puntuale delle tasse amministrative e di registrazione.
- Rinnovo delle licenze
- Collegamento tra il DMEHW e il produttore
- Gestione delle importazioni
Sintesi
Gruppo | Classe | Il rischio | Percorso normativo | Linee temporali | Validità |
|---|---|---|---|---|---|
Gruppo 1 | Classe A | Livello basso | Dichiarazione dello standard applicabile | 15 - 60 giorni | Illimitato |
Gruppo 2 | Classe B | Livello medio di rischio più basso | Certificato di registrazione di libera vendita | 15 - 60 giorni | 5 anni |
Classe C | Livello medio superiore di rischio | Certificato di registrazione di libera vendita | 15 - 60 giorni | 5 anni | |
Classe D | Alto livello di rischio | Certificato di registrazione di libera vendita | 15 - 60 giorni | 5 anni |
Competenza di Freyr
- Due diligence normativa
- Classificazione ufficiale
- Registrazione del dispositivo
- Licenza di importazione
- Supporto per l'etichettatura
- Supporto alla traduzione
- Identificazione e qualificazione dei distributori
- Sorveglianza post marketing
- Gestione delle modifiche successive all'approvazione
- Rinnovo e trasferimento della licenza
- Presentazione e collegamento
- Sdoganamento

