Panoramica sulla registrazione dei dispositivi medici in Argentina
L'Argentina è uno dei Paesi in rapido sviluppo dell'America Latina che offre opportunità alle aziende produttrici di dispositivi medici con un sistema sanitario noto per la sua dedizione alla sicurezza dei pazienti e ai servizi medici di alta qualità. La registrazione dei dispositivi medici in Argentina è supervisionata dall'autorità di regolamentazione - l'Amministrazione nazionale dei farmaci, degli alimenti e dei dispositivi medici (ANMAT).

Autorità di regolamentazione: Amministrazione nazionale dei farmaci, degli alimenti e dei dispositivi medici (ANMAT)
Regolamenti: Disposizione 2318/2002 e Disposizione 727/2013.
Percorso normativo: Sistema elettronico di notifica via web dei dispositivi (WAND)
Rappresentante autorizzato: Rappresentante autorizzato per l'Argentina (AAR)
Requisiti del SGQ: ISO 13485 (ANMAT MDS) e MDSAP (membro affiliato).
Valutazione dei dati tecnici: Amministrazione nazionale dei farmaci, degli alimenti e dei dispositivi medici (ANMAT)
Requisiti di etichettatura: Allegato III.B del Provvedimento 2318/2002 e Allegato V del Provvedimento 727/2013.
Formato di presentazione: Elettronico (portale HELENA)
Lingua: Spagnolo
Classificazione dei dispositivi medici in Argentina
Nel processo normativo ANMAT, il primo passo per determinare il percorso di registrazione e la conformità alle normative argentine è la determinazione della classificazione del dispositivo medico. In Argentina, i dispositivi sono classificati in quattro (04) classi in base al rischio (Classe I-IV).
| Classe del dispositivo medico | Criteri |
|---|---|
| Classe I | Basso rischio |
| Classe II | Rischio basso - moderato |
| Classe III | Rischio elevato - moderato |
| Classe IV | Alto rischio |
| Classe IVD | Criteri |
|---|---|
| Classe A | Diagnosi di malattie non infettive o non trasmissibili. |
| Classe B | Diagnosi di malattie infettive ad eccezione di quelle appartenenti alla classe C. |
| Classe C | Diagnosi di malattie infettive a trasmissione sessuale o trasmesse dal sangue o dai suoi derivati, nonché per l'identificazione dei gruppi sanguigni. |
| Classe D | Per l'autovalutazione. |
Rappresentante autorizzato per l'Argentina (AAR)
Il titolare della registrazione di un dispositivo medico in Argentina è legalmente responsabile della registrazione e della commercializzazione del dispositivo nel Paese. Può essere il fabbricante del dispositivo o un rappresentante autorizzato locale (AAR) in Argentina che agisce per conto del fabbricante.
Tutti i dispositivi medici commercializzati in Argentina devono essere registrati presso l'ANMAT. Il processo di registrazione può essere complesso e richiedere tempo, quindi si raccomanda spesso ai produttori esteri di nominare un AAR per assisterli.
Registrazione dei dispositivi medici ANMAT
Il processo di registrazione dei dispositivi medici ANMAT è simile ai processi di notifica e registrazione brasiliani, con l'entità del controllo richiesto per l'approvazione che aumenta in base alla classificazione del dispositivo (Classe I, II, III e IV). Tutti i produttori di dispositivi medici devono inoltre conformarsi all'ANMAT-MDS, che è l'equivalente argentino del BGMP ed è anche in linea con la ISO 13485:2016.
Flusso di processo
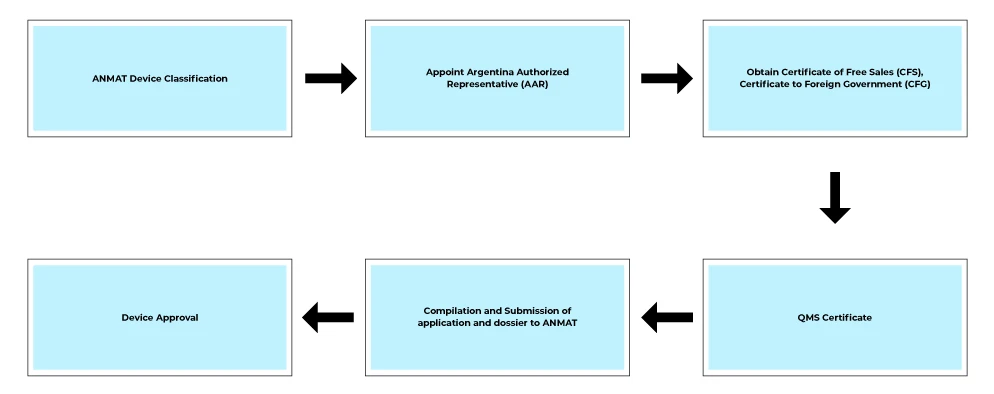
Servizi post-approvazione
Freyr supporta i produttori esteri nella gestione End-to-End del ciclo di vita dei dispositivi medici, incluse le attività post-approvazione, come –
- Gestione delle modifiche post-approvazione - modifiche alle approvazioni dei dispositivi medici esistenti, come l'aggiunta di nuove varianti, accessori e nuove indicazioni d'uso.
- Mantenimento delle approvazioni e della registrazione attraverso il pagamento puntuale delle tasse amministrative e di registrazione.
- Rinnovo delle licenze.
- Collegamento tra ANMAT e il produttore.
- Segnalazione degli eventi avversi.
- Gestione delle importazioni.
Freyr assiste i produttori nell'identificazione della classificazione dei dispositivi come primo passo. Freyr aiuta i clienti a orientarsi nel percorso normativo e a ottenere le certificazioni risolvendo le complessità normative coinvolte. Con una comprovata esperienza nel lancio di numerosi dispositivi nella regione, Freyr offre servizi normativi End-to-End per i dispositivi medici.
Sintesi
| Classe di dispositivi | Percorso di registrazione (notifica o registrazione completa) | Tempistiche dell'Agenzia sanitaria | Validità della registrazione (anni) |
|---|---|---|---|
| Dispositivi di Classe I | Registrazione completa | 4- 6 mesi | 5 anni |
| Dispositivi di Classe II | Registrazione completa | 4- 6 mesi | 5 anni |
| Dispositivi di Classe III | Registrazione completa | 6-8 mesi | 5 anni |
| Dispositivi di classe IV | Registrazione completa | 6-8 mesi | 5 anni |
*Si prega di notare che fattori quali limitazioni della larghezza di banda, aggiornamenti normativi e altre variabili possono comportare un'estensione delle tempistiche dell'Autorità sanitaria.
Competenza di Freyr
- Servizi di relazione sull'intelligence normativa.
- Servizi di classificazione ufficiale.
- Compilazione di documenti tecnici.
- Servizi di registrazione dei dispositivi.
- Servizi del Rappresentante Autorizzato Argentina (AAR).
- Servizi di importazione.
- Permessi e autorizzazioni di esercizio.
- Servizi di traduzione.
- Servizi di Labelling e Artwork.
- Servizi di identificazione e qualificazione dei distributori.
- Sorveglianza post-vendita.
- Servizi di rinnovo e trasferimento delle licenze.