Panoramica sulla registrazione dei dispositivi medici in Colombia
La Colombia offre enormi opportunità alle aziende produttrici di dispositivi medici e il suo sistema sanitario è rinomato per l'impegno verso la sicurezza dei pazienti e la qualità dei servizi medici e regolamenta i dispositivi medici attraverso l'INVIMA (l'Istituto Nazionale per la Sorveglianza degli Alimenti e dei Medicinali). L'INVIMA è l'autorità operativa per la registrazione dei dispositivi medici in Colombia.

Autorità di regolamentazione: INVIMA (Istituto Nazionale per la Sorveglianza degli Alimenti e dei Medicinali)
Regolamento: Decreto 4725/2005
Percorso normativo: Registrazione del dispositivo
Rappresentante autorizzato: Rappresentante legale per la Colombia
Requisiti del SGQ: ISO 13485:2016 / MDSAP
Valutazione dei dati tecnici: INVIMA
Requisiti di etichettatura: I documenti di etichettatura devono essere in lingua spagnola
Validità della licenza: 10 anni
Formato di presentazione: Elettronica
Classificazione dei dispositivi medici in Colombia
| Classificazione dei dispositivi medici | |
|---|---|
| Classe I (rischio più basso) | |
| Classe IIa | |
| Classe IIb | |
| Classe III (rischio più elevato) | |
Rappresentante legale per la Colombia
Per essere un Rappresentante Legale in Colombia, è necessario avere la cittadinanza colombiana o possedere l'autorizzazione legale necessaria per risiedere e lavorare nel Paese come cittadino straniero. Un Rappresentante Legale può assistere e gestire tutte le procedure di registrazione in Colombia, facendo da tramite tra l'azienda e l'INVIMA, l'autorità di regolamentazione locale.
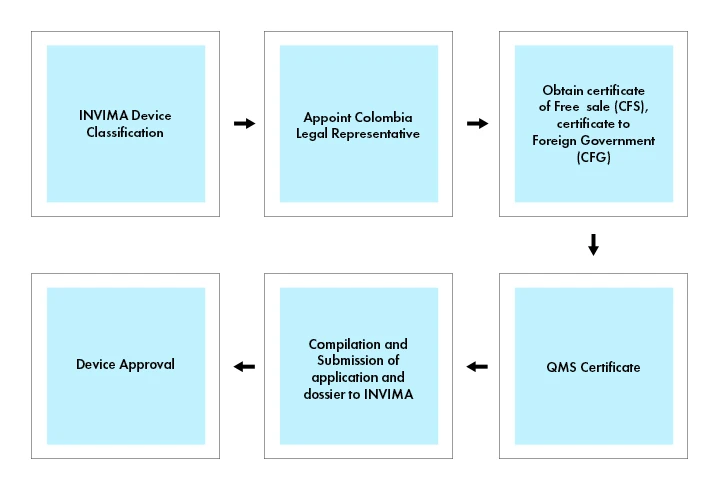
Registrazione dei dispositivi medici in Colombia
I dispositivi medici e gli IVD sono soggetti a una procedura di registrazione, pertanto i dispositivi medici devono essere registrati presso l'INVIMA per essere commercializzati in Colombia.
Per commercializzare un dispositivo medico in Colombia, è necessario ottenere un Certificato di Libera Vendita (CFS) o un Certificato di Governo Straniero (CFG) rilasciato dall'agenzia regolatoria competente del Paese di origine o di un Paese di riferimento riconosciuto (ad esempio, Canada, Giappone, Australia, Unione Europea e Stati Uniti). Il Certificato di libera vendita o il Certificato al Governo straniero servono a dimostrare che il dispositivo medico soddisfa gli standard di sicurezza e qualità necessari per la vendita in Colombia.
Flusso di processo
Gestione del ciclo di vita del dispositivo dopo l'approvazione
Freyr supporta i produttori esteri nella gestione End-to-End del ciclo di vita dei dispositivi medici, incluse le attività post-approvazione, come:
- Gestione delle modifiche post-approvazione - modifiche alle approvazioni dei dispositivi medici esistenti, come l'aggiunta di nuove varianti e accessori, l'aggiunta di nuove indicazioni d'uso, ecc.
- Mantenimento delle approvazioni e della registrazione attraverso il pagamento puntuale delle tasse amministrative e di registrazione.
- Rinnovo delle licenze
- Collegamento tra INVIMA e la produzione
Sintesi
| Classificazione dei dispositivi medici | Nuove licenze e rinnovi | ||
|---|---|---|---|
| Nuova registrazione | Emendamento | Rinnovo | |
| Classe I | 4-6 mesi | 2-3 mesi | 4-6 mesi |
| Classe IIa | 4-6 mesi | 2-3 mesi | 4-6 mesi |
| Classe IIb | 4-6 mesi | 2-3 mesi | 4-6 mesi |
| Classe III | 4-6 mesi | 2-3 mesi | 4-6 mesi |
| Tasse di registrazione | |||||
|---|---|---|---|---|---|
| Nuove licenze e rinnovi | Modifiche tecniche | Modifiche amministrative | |||
| Classe I e Classe IIa | Classe IIb e Classe III | Classe I e Classe IIa | Classe IIb e Classe III | Classe I e Classe IIa | Classe IIb e Classe III |
| $ 690,00 | $ 776,00 | $ 196,00 | $ 196,00 | $ 153,00 | $ 153,01 |
Competenza di Freyr
- Due diligence normativa
- Classificazione ufficiale
- Registrazione del dispositivo
- Colombia Titolare della registrazione
- Supporto per l'etichettatura
- Supporto alla traduzione
- Identificazione e qualificazione dei distributori
- Sorveglianza post marketing
- Gestione delle modifiche successive all'approvazione
- Rinnovo e trasferimento della licenza
- Presentazione e collegamento con l'INVIMA