Protocollo di ricerca e revisione della letteratura sui dispositivi medici - Panoramica
Nell'intricato regno dei dispositivi medici e della diagnostica in vitro (IVD), l'importanza di un protocollo di ricerca e revisione della letteratura sui dispositivi medici ben strutturato trascende la semplice esplorazione della ricerca. Emerge come una pietra miliare per il raggiungimento della conformità ai severi requisiti di sicurezza e prestazioni stabiliti da normative come il Regolamento dell'Unione Europea sui Dispositivi MediciEU MDR) 2017/745 e il Regolamento dell'Unione Europea sui Diagnostici in Vitro (EU IVDR) 2017/746.
Rassegna della letteratura EU MDR
La revisione della letteratura svolge un ruolo cruciale nella gestione del ciclo di vita di un dispositivo medico. Una strategia di ricerca sistematica della letteratura EU MDR è la spina dorsale per il successo della valutazione clinica, della valutazione delle prestazioni e anche della sorveglianza post-vendita e dei rapporti di follow-up clinico/prestazionale post-vendita. Ancorata a una strategia di ricerca sistematica della letteratura, questa revisione non è solo una fase, ma anche un faro che guida verso un processo decisionale informato.
Il potere di un solido team di sintesi della letteratura scientifica
I produttori che operano nel complesso settore dei dispositivi medici e dei dispositivi medico-diagnostici in vitro (IVD) necessitano di più di una semplice revisione della letteratura di routine. Un team solido specializzato nella sintesi della letteratura scientifica, con profonda esperienza nell'area terapeutica, è la bussola che li guida attraverso il labirinto dei requisiti normativi, garantendo che la conformità non sia solo raggiunta, ma addirittura superata.
Protocollo di ricerca della letteratura EU MDR
Le fasi seguenti costituiscono il processo del protocollo di ricerca della letteratura EU MDR :
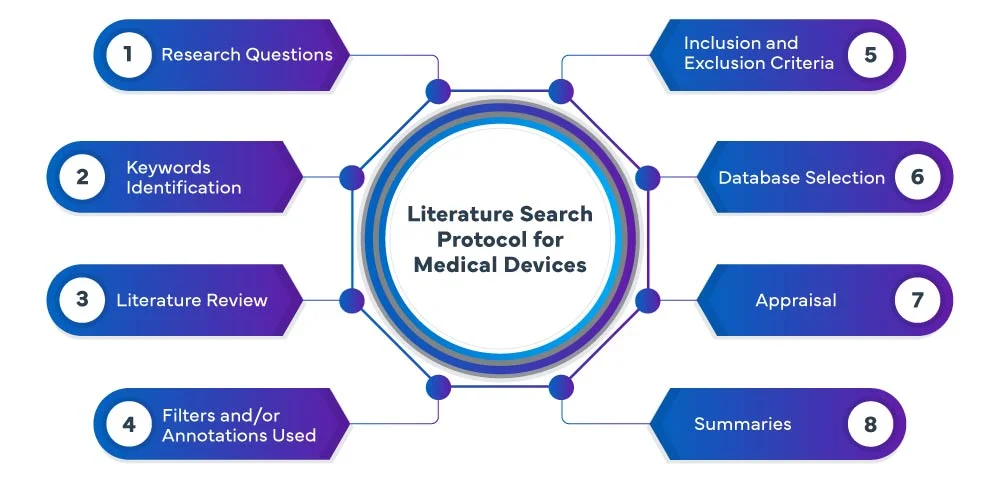
Freyr conduce un protocollo di ricerca e revisione sistematica ed esaustiva della letteratura sui dispositivi medici in vari database, tra cui PubMed, Embase e Cochrane, per identificare studi e pubblicazioni rilevanti relativi al vostro dispositivo medico. Il nostro team utilizza strategie di ricerca avanzate per garantire l'acquisizione di tutte le prove pertinenti. Analizziamo e riassumiamo meticolosamente i risultati, fornendovi una revisione completa che funge da base per il processo di sviluppo o valutazione del vostro dispositivo.
Siamo consapevoli che ogni dispositivo medico è unico e che ogni categoria di prodotto richiede soluzioni personalizzate. Lavoriamo a stretto contatto con voi per comprendere le vostre esigenze e fornirvi servizi personalizzati che soddisfino efficacemente i vostri obiettivi.
Protocollo di ricerca e revisione della letteratura sui dispositivi medici
- Identificare, cercare, analizzare e mettere insieme la letteratura scientifica appropriata.
- Strategia delle stringhe di ricerca e inclusione/esclusione dei criteri.
- Individuare la banca dati più adatta per il rapporto di ricerca della letteratura, in base ai requisiti.
- Raccolta dei dati della letteratura.
- Esame della letteratura pertinente.
- Integrazione dei dati PMS (se applicabile).
- Documentazione e reportistica.
- Creazione del Clinical Evaluation Report (CER), come da normativa EU MDR 2017/745.
- Creare un Clinical Evaluation Plan (CEP) per la vostra organizzazione.
- Esecuzione di una valutazione delle lacune delle CEP esistenti.

- Garantire la conformità alle recenti normative applicabili.
- Un team di esperti clinici qualificati.
- Scalabilità del team.
- Soluzioni su misura per le vostre esigenze.
- Contributi interfunzionali da parte di esperti di dispositivi medici per soddisfare i requisiti.
- Servizio completo di conformità, revisione e pianificazione.