Panoramica sulla registrazione dei dispositivi medici in Egitto
Da settembre 2018, la registrazione dei dispositivi medici è diventata obbligatoria in Egitto. L'industria dei dispositivi medici nel paese ha registrato una crescita costante, rendendo un mercato attraente per produttori e distributori. Con una valutazione di 4,0 miliardi di dollari nel 2021, il mercato egiziano dei dispositivi medici dovrebbe raggiungere un Tasso di Crescita Annuo Composto (CAGR) di oltre il 3% dal 2022 al 2027. L'importazione soddisfa in gran parte la domanda di dispositivi medici in Egitto, data la produzione locale relativamente bassa. In particolare, il mercato egiziano dei dispositivi medici si posiziona come il secondo più grande nella regione del Medio Oriente e del Nord Africa (MENA). Questa panoramica esplora gli aspetti chiave del processo di registrazione egiziano, offrendo approfondimenti sul quadro normativo e sui requisiti per portare dispositivi medici innovativi all'avanguardia nel settore sanitario egiziano.
Autorità di regolamentazione: Autorità egiziana per i farmaci (EDA)
Regolamento: Legge egiziana sui dispositivi medici Legge n. 10 del 2003
Percorso normativo: Registrazione del prodotto (normale e rapida) e classificazione ufficiale.
Egitto Rappresentante locale autorizzato: Titolare della registrazione egiziana (ERH)
Requisiti del SGQ: ISO 13485
Valutazione dei dati tecnici: Il Centro per la politica e la pianificazione dei farmaci (DPPC) e l'Amministrazione centrale degli affari farmaceutici (CAPA).
Validità della licenza: Dieci (10) anni
Formato di presentazione: Cartaceo ed elettronico
Traduzione: Documenti tradotti in arabo e inglese
Classificazione del dispositivo
In Egitto, la classificazione dei dispositivi medici si allinea al sistema di classificazione europeo, che categorizza i dispositivi medici in base all'uso previsto e ai potenziali rischi associati al loro utilizzo. I produttori devono identificare la classificazione corretta dei loro dispositivi per garantire la conformità ai requisiti normativi e ottenere le approvazioni necessarie per la commercializzazione e la distribuzione in Egitto.
Classi di dispositivi medici
| Classe | Il rischio |
|---|---|
| Classe I | Basso |
| Classe II a | Medio-basso |
| Classe II b | Medio-alto |
| Classe III | Alto |
Egitto Rappresentante locale autorizzato
Le aziende produttrici di dispositivi medici con sede al di fuori dell'Egitto devono designare un agente locale, chiamato "Egyptian Registration Holder (ERH)", che si occupi della presentazione delle domande di registrazione e dei dossier all'EDA per loro conto. L'ERH funge da collegamento tra il produttore e l'autorità regolatoria, assicurando l'accurata preparazione e presentazione di tutta la documentazione richiesta e verificando che il dispositivo medico soddisfi gli standard di sicurezza, qualità ed efficacia dell'EDA. Inoltre, l'ERH è responsabile della conservazione della documentazione di registrazione, della segnalazione di incidenti o richiami e della costante aderenza a tutti gli standard e le normative applicabili durante l'intero ciclo di vita del dispositivo. Il titolare della registrazione egiziana (ERH) è interamente responsabile di garantire la registrazione di un dispositivo medico presso l'EDA, in particolare all'interno dell'Amministrazione centrale dei dispositivi medici. Questo ruolo consiste nel garantire la conformità del dispositivo ai requisiti normativi dell'EDA per la commercializzazione e la distribuzione in Egitto.
Registrazione dei dispositivi medici
L'ottenimento dell'autorizzazione all'immissione in commercio di un dispositivo medico in Egitto comprende diverse fasi, tra cui la preparazione della documentazione richiesta, la presentazione della domanda all'EDA, il rispetto dei requisiti di classificazione e del sistema di qualità, la nomina di un ERH, se necessario, e l'adempimento degli obblighi post-vendita. Il processo di registrazione è fondamentale per garantire che i dispositivi medici siano conformi agli standard di sicurezza, qualità ed efficacia stabiliti dall'Autorità di regolamentazione egiziana. La documentazione richiesta può variare a seconda del percorso di registrazione scelto, ma in genere comprende i seguenti elementi:
- Certificato CE (se applicabile).
- Certificato di Libera Vendita (CFS).
- Certificazione ISO 13485 .
- Dichiarazione di conformità (DOC).
Flusso di processo
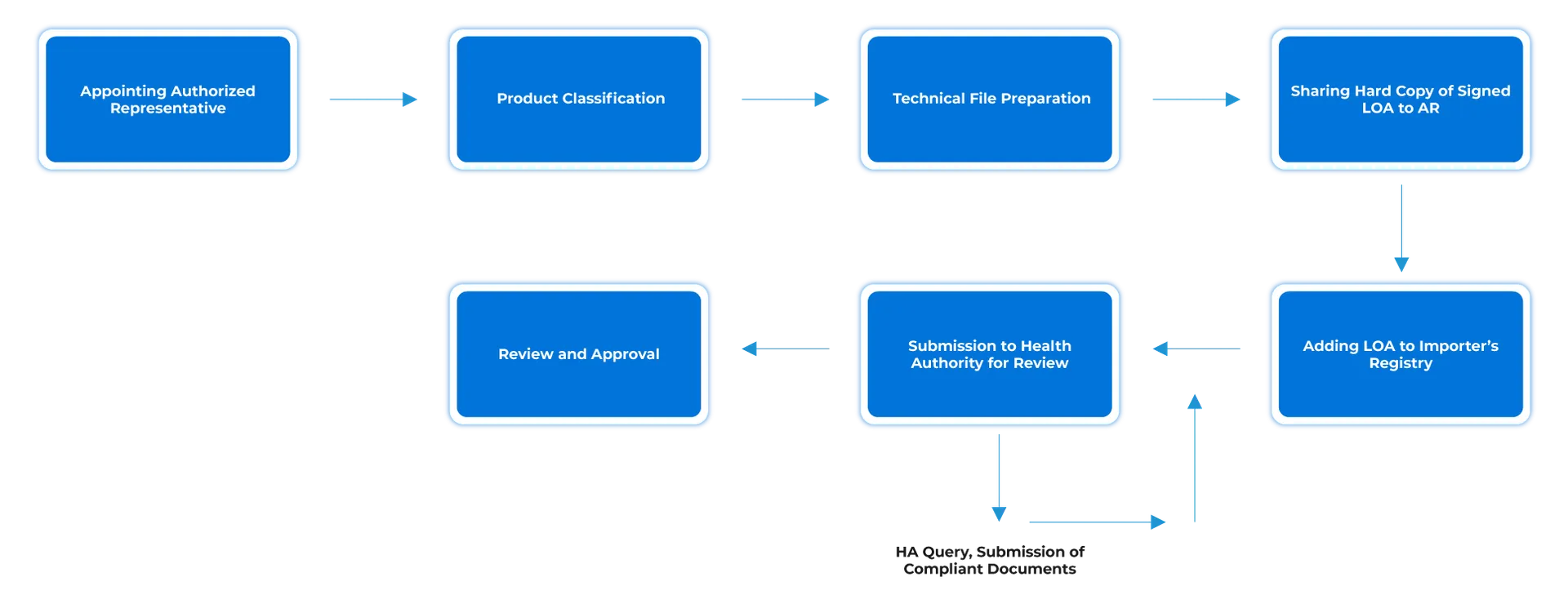
Gestione del ciclo di vita del dispositivo post-approvazione
Freyr offre un supporto completo ai produttori esteri nella gestione dell'intero ciclo di vita dei dispositivi medici in Egitto, incluse le attività post-approvazione:
- Gestione delle modifiche post-approvazione, che riguarda le modifiche alle approvazioni dei dispositivi medici esistenti, come l'aggiunta di nuove varianti, accessori e indicazioni d'uso.
- Manutenzione della ISO 13485:2016.
- Certificazione CE.
- Agisce come intermediario tra l'organismo notificato (NB) e il produttore.
- Un sistema di vigilanza per monitorare la sicurezza del dispositivo medico dopo il rilascio dell'autorizzazione all'immissione in commercio.
- Fornire aggiornamenti periodici sulla sicurezza e l'efficacia del dispositivo medico, nonché su eventuali modifiche dello stato normativo in altre giurisdizioni.
- Rinnovo dell'autorizzazione all'immissione in commercio, a seconda del tipo di dispositivo e delle normative, dopo un certo periodo.
La gestione efficace della Post-market Surveillance (PMS) in Egitto implica la navigazione esperta dei quadri normativi stabiliti dall'EDA. I nuovi operatori del mercato che lottano con queste complessità e che non dispongono di un partner normativo consolidato possono avvalersi degli ampi servizi normativi offerti da Freyr. Questi servizi contribuiscono a un processo di approvazione senza interruzioni per i dispositivi medici in Egitto, garantendo la conformità continua con il panorama normativo in continua evoluzione e le dinamiche di mercato.
Registrazione dei dispositivi medici in Egitto Competenze
- Intelligenza normativa.
- Due diligence normativa.
- Classificazione dei dispositivi medici.
- Registrazione del dispositivo.
- Titolare della registrazione egiziana.
- Supporto alla traduzione.
- Scrittura medica.
- Supporto per l'etichettatura.
- Identificazione e qualificazione del distributore.
- Gestione delle modifiche successive all'approvazione.
- Rinnovo e trasferimento della licenza.
- Sdoganamento.
