
Registrazione dei dispositivi medici in Indonesia Panoramica
L'Indonesia ha avviato l'assistenza sanitaria universale per i propri cittadini nel 2014. Questo ha influenzato notevolmente la crescita del mercato dei dispositivi medici e ha portato a un aumento delle importazioni di dispositivi medici. I dispositivi in Indonesia sono regolamentati dall'Agenzia nazionale per il controllo dei farmaci e degli alimenti (NADFC), che opera nell'ambito del Ministero della Salute indonesiano (MoH). L'ultima normativa in vigore per l'importazione di dispositivi medici è il Decreto n. 62 imposto nel 2017. Le aziende straniere devono nominare un rappresentante autorizzato locale per il processo di registrazione dei dispositivi medici in Indonesia.
Autorità di regolamentazione: Agenzia nazionale per il controllo dei farmaci e degli alimenti (NADFC)
Regolamento: No. 62 / 2017
Rappresentante autorizzato: Indonesia Rappresentante autorizzato locale
Requisito del SGQ: ISO 13485:2016
Valutazione dei dati tecnici: NADFC
Validità della licenza: 5 anni
Requisiti di etichettatura: No. 62 / 2017
Formato di presentazione: Online/Cartaceo
Lingua: Inglese e indonesiano
Classificazione dei dispositivi medici in Indonesia
L'attuale normativa classifica i dispositivi come A, B, C e D in base al rischio.
| Criteri di rischio | Classe del dispositivo |
|---|---|
| Basso rischio | A |
| Rischio basso e moderato | B |
| Rischio moderato-alto | C |
| Alto rischio | D |
Indonesia Rappresentante autorizzato locale
Le normative indonesiane richiedono ai produttori di nominare un rappresentante locale con una Licenza di Distributore. Un distributore può essere nominato per rappresentare il produttore straniero in Indonesia. Tuttavia, la nomina di una terza parte indipendente fornirebbe flessibilità per cambiare distributori o nominarne più di uno per una migliore penetrazione del mercato.
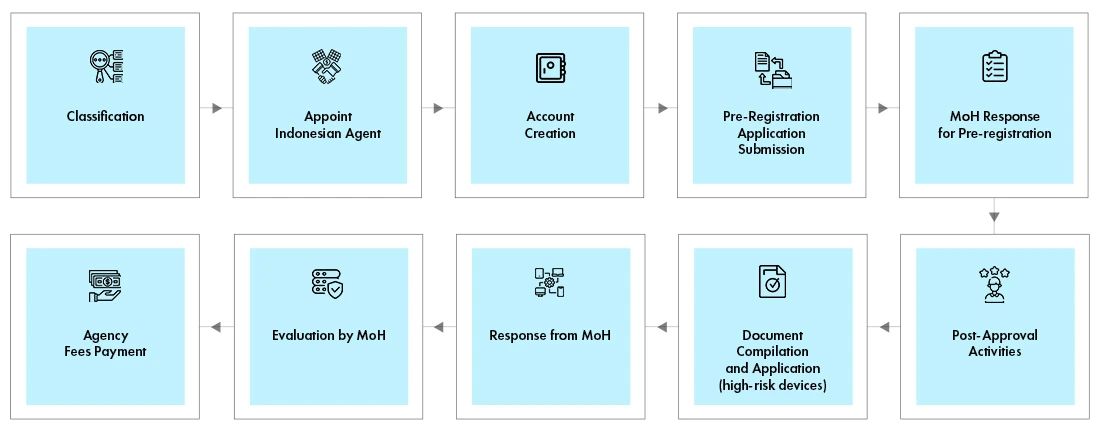
Registrazione dei dispositivi medici in Indonesia
Il Rappresentante locale deve creare un account nel portale online. La procedura di registrazione è la stessa per tutte le classi di dispositivi. Tuttavia, i requisiti di documentazione variano a seconda della classe del dispositivo. La registrazione avviene in due fasi
- Processo di pre-registrazione
- Processo di valutazione
Il Ministero della Salute verifica la classificazione del dispositivo e determina il costo della valutazione. Il risultato della pre-registrazione, insieme alla fattura, viene inviato per e-mail al richiedente. Il rappresentante locale, a nome del produttore, deve effettuare il pagamento e caricare la prova di pagamento. Il Ministero della Salute esaminerà i documenti e comunicherà i risultati via e-mail al richiedente. Alcuni dispositivi richiedono test in loco presso un laboratorio accreditato.
Panoramica del processo di approvazione normativa
Il team di esperti Freyrtiene traccia delle tendenze e delle normative in evoluzione e aiuta gli stakeholder a mantenere la conformità normativa durante tutto il ciclo di vita del prodotto. Offriamo soluzioni normative per mantenere altri aspetti normativi di conformità entro i limiti di budget prestabiliti.
Classe del dispositivo | Classe di rischio | MoH Tempistiche per Autorizzazione alla commercializzazione | MoH Tempistiche per Rinnovo / Variazione | ||
|---|---|---|---|---|---|
| Processo di classificazione (giorni) | Processo di valutazione (giorni) | Processo di classificazione (giorni) | Processo di valutazione (giorni) | ||
| Classe A | Basso rischio | 7 | 45 | 7 | 45 |
| Classe B | Rischio basso e moderato | 7 | 90 | 7 | 45 |
| Classe C | Rischio moderato-alto | 7 | 100 | 7 | 45 |
| Classe D | Alto rischio | 7 | 120 | 7 | 45 |
Competenza di Freyr
- Due diligence normativa
- Registrazione del dispositivo
- Test nel paese
- Licenze per i distributori
- Legalizzazione e notariato
- Rappresentante legale
- Supporto al Labelling
- Supporto alla traduzione
- Identificazione e qualificazione dei distributori
- Servizi di sorveglianza post marketing
- Gestione delle modifiche successive all'approvazione
- Servizi di rinnovo e trasferimento delle licenze
- Servizi di presentazione e collegamento

