Panoramica sulla registrazione dei dispositivi medici in Israele
L'industria israeliana dei dispositivi medici sta vivendo una crescita e un'innovazione sostenute, che la rendono un polo di attrazione per le tecnologie sanitarie all'avanguardia. La registrazione dei dispositivi medici è fondamentale per le aziende che entrano in questo mercato dinamico. Questa panoramica esplora gli aspetti chiave del processo di registrazione in Israele, offrendo approfondimenti sul quadro normativo e sui requisiti per portare i dispositivi medici innovativi in prima linea nel settore sanitario israeliano.
Autorità di regolamentazione: La Divisione Dispositivi Medici del Ministero della Salute israeliano (AMAR).
Regolamento: Legge sui dispositivi/attrezzature mediche del 2012
Percorso normativo: Registrazione del prodotto
Rappresentante locale autorizzato in Israele: Titolare della registrazione in Israele (IRH)
Requisiti del SGQ: ISO 13485
Valutazione dei dati tecnici: Il Dipartimento dei dispositivi medici del Ministero della Salute
Validità della licenza: Cinque (05) anni
Formato di presentazione: Cartaceo ed elettronico
Traduzione: Documenti tradotti in ebraico
Classificazione del dispositivo
La legge e i regolamenti per la registrazione dei dispositivi medici in Israele non specificano un sistema di classificazione dei rischi. Al contrario, Israele allinea la propria classificazione dei dispositivi medici agli standard internazionali, in particolare a quelli delineati dai Paesi della Global Harmonization Task Force (GHTF). In alternativa, la classificazione del rischio di un dispositivo in un Paese riconosciuto viene adottata per la registrazione in Israele. Questo processo di classificazione considera in genere l'uso previsto, il livello di rischio e altri fattori che possono influire sulla sicurezza e sull'efficacia dei dispositivi medici.
Classi di dispositivi medici
| Classe | Il rischio |
|---|---|
| Classe I | Basso |
| Classe II | Medio-basso |
| Classe III | Alto |
Modifiche proposte ai percorsi di registrazione
Le modifiche proposte si applicano ai dispositivi di Classe I e Classe II, mentre il sistema di registrazione per i dispositivi di Classe III rimane invariato.
- I dispositivi di Classe I possono essere immediatamente registrati tramite autodichiarazione.
- Per i dispositivi di Classe II, sebbene siano necessarie dichiarazioni e documenti tecnici, l'AMAR può accelerare il processo a quattordici giorni per quelli considerati a rischio medio-basso. Ciò si applica se il produttore detiene due autorizzazioni da paesi riconosciuti e fornisce sei mesi di dati di mercato. In alternativa, per i dispositivi di Classe II con solo l'autorizzazione US FDA 510(k) e sei mesi di dati di mercato US, il tempo di elaborazione AMAR è accelerato a sessanta giorni.
Israele Rappresentante locale autorizzato
Le aziende produttrici di dispositivi medici con sede al di fuori di Israele devono designare un Israeli Registration Holder (IRH) per facilitare la registrazione dei loro prodotti per la vendita nel Paese. L'IRH agisce come rappresentante locale del produttore ed è incaricato di mantenere i contatti con il Ministero della Salute per garantire l'aderenza alle normative locali. Inoltre, l'IRH è responsabile di stabilire e mantenere una presenza commerciale in Israele, nonché di ottenere e mantenere una licenza commerciale valida.
Registrazione dei dispositivi medici
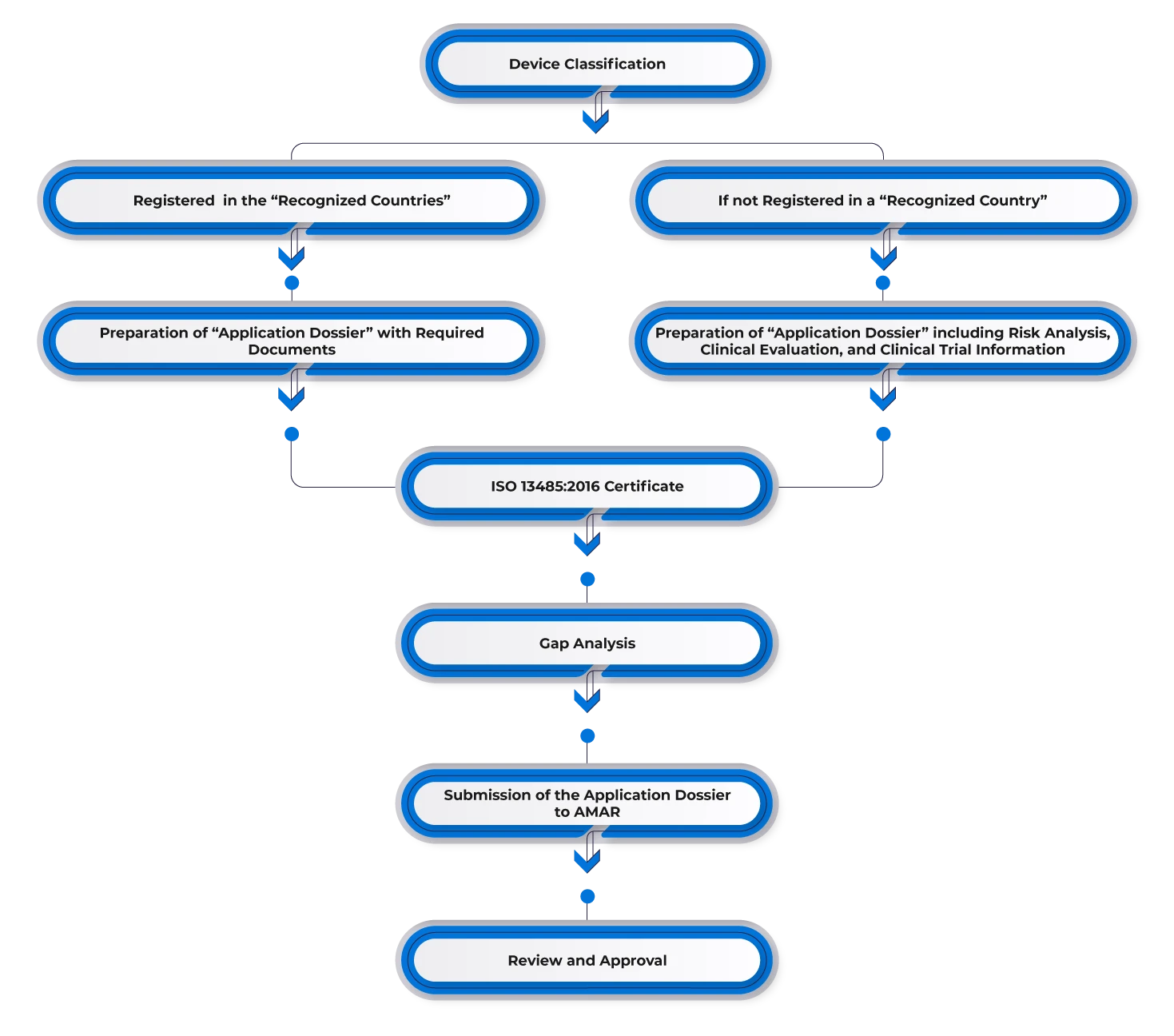
Per registrare un dispositivo medico in Israele, i produttori devono ottenere l'approvazione preventiva in uno dei mercati di riferimento come gli STATI UNITI D'AMERICA, l'Europa, l'Australia, il Canada o altri mercati importanti. I produttori con approvazioni esistenti in uno dei paesi di riferimento possono utilizzare questa approvazione per il mercato israeliano e nominare un rappresentante locale. Successivamente, devono presentare la documentazione richiesta, inclusi:
- FDA (k)/Lettera di approvazione pre-commercializzazione/CE.
- Certificato al governo straniero (CFG)/Certificato di libera vendita (CFS).
- ISO 13485 altra certificazione riconosciuta di buone pratiche di fabbricazione (GMP).
- Convalida e certificazione da parte dello Standards Institute of Israel (se necessario).
Flusso di processo
Gestione del ciclo di vita del dispositivo post-approvazione
Freyr offre un supporto completo ai produttori esteri nella gestione dell'intero ciclo di vita dei dispositivi medici in Israele, incluse le attività post-approvazione:
- Gestione delle modifiche post-approvazione, che riguarda le modifiche alle approvazioni dei dispositivi medici esistenti, come l'aggiunta di nuove varianti, accessori e indicazioni d'uso.
- Mantenimento della certificazione ISO 13485:2016 e CE.
- Rinnovo delle licenze.
- Agisce come intermediario tra l'organismo notificato (NB) e il produttore.
Orientarsi nelle complessità degli organismi di autorizzazione e conformarsi a molteplici normative per le approvazioni dei dispositivi può essere difficile. Ottenere approvazioni da vari paesi GHTF e aderire alle normative specifiche per stato richiede una conoscenza normativa approfondita. Per gli operatori che affrontano queste complessità senza un partner normativo consolidato, Freyr offre servizi normativi End-to-End, semplificando il processo di approvazione per i dispositivi medici in Israele.
Registrazione dei dispositivi medici in Egitto Competenze
- Classificazione dei dispositivi medici in Israele.
- Titolare della registrazione in Israele (IRH).
- Israele Registrazione del dispositivo.
- ISO 14971:2019 Consultazione sulla gestione del rischio.
- Conformità alla norma ISO 13485:2016.
- Revisione, compilazione e presentazione del dossier di progettazione.
- Registrazione dei dispositivi medici tramite il sistema di registrazione online.
- Rapporto sulla strategia normativa dei dispositivi medici.
- Supporto ai test: biocompatibilità, sicurezza elettrica, meccanica e prestazioni.
- Supporto per la conformità delle etichette.
- Assistenza GMP.
- Supporto per la Post-Market Surveillance (PMS).
