Servizi di regolamentazione dei dispositivi medici
a Singapore Panoramica
I dispositivi medici a Singapore sono regolamentati dall'Health Products Act (HPA) e dai relativi Health Product (Medical Devices) Regulations 2010.
Autorità di regolamentazione: Autorità sanitariaHSA)
Regolamento: Regolamento 2010 sui prodotti sanitari (dispositivi medici)
Percorso normativo: Sezione Dispositivi Medici dell'Autorità per le Scienze della SaluteHSA)
Rappresentante autorizzato: Singapore Registrant
Requisito del SGQ: SS 620:2016, Standard di Singapore per le buone pratiche di distribuzione dei dispositivi medici e ISO 13485:2016.
Valutazione dei dati tecnici: Autorità sanitariaHSA)
Validità della licenza: Tutte le licenze per i concessionari sono valide per 12 mesi dalla data di approvazione.
Requisiti di Labelling: Guida normativa, GN- 23 Revisione (1 marzo 2020)
Formato di presentazione: In linea
Lingua: Inglese
Classificazione dei dispositivi medici HSA
LHSA applica 16 serie di regole per classificare i dispositivi medici dal rischio più basso a quello più alto in Classe A, B, C e D.
La classificazione del rischio dipende da fattori quali la durata del contatto, il grado di invasività, l'uso previsto e il metodo di somministrazione.
Classificazione dei dispositivi medici, HSA
| Classe di rischio | Livello di rischio | Esempi di dispositivi medici |
|---|---|---|
| Classe A | Basso rischio | Visore per film, mano chirurgica, guaina, maschera d'ossigeno |
| Classe B | Rischio da basso a moderato | Bracciale per la pressione sanguigna, sterilizzatore per steli |
| Classe C | Rischio da moderato ad alto | Monitor paziente, mesin X-ray |
| Classe D | Alto rischio | Stent cardiaci, pacemaker |
Classificazione IVD
I dispositivi medici in vitro sono classificati di seguito dal rischio più basso a quello più alto.
Classe di rischio | Livello di rischio | Esempi di dispositivi medici in vitro |
|---|---|---|
| Classe A | Basso rischio individuale e basso rischio per la salute pubblica | Recipiente per campioni |
| Classe B | Rischio individuale moderato o basso rischio per la salute pubblica o entrambi. | Vitamina B12, autoanalisi di gravidanza, anticorpi antinucleari, strisce reattive per le urine |
| Classe C | Rischio individuale elevato o rischio moderato per la salute pubblica o entrambi. | Autodiagnosi della glicemia, tipizzazione HLA, screening PSA , rosolia IgM |
| Classe D | Alto rischio individuale e alto rischio per la salute pubblica | Screening dei donatori di sangue per l'HIV, kit diagnostico per l'HIV |
Rappresentante autorizzato per i dispositivi medici di Singapore / Registrante
Un Registrant è il collegamento tra la vostra azienda e l'HSA, who gestisce l'elenco dei dispositivi registrati a Singapore. Il rappresentante autorizzato per i dispositivi medici di Singapore elabora la domanda di registrazione con l'HSA e possiede la registrazione del dispositivo HSA . Solo le aziende o le entità con sede a Singapore possono agire come Registrant; devono anche essere registrate presso l'HSA.
Registrazione dei dispositivi medici HSA
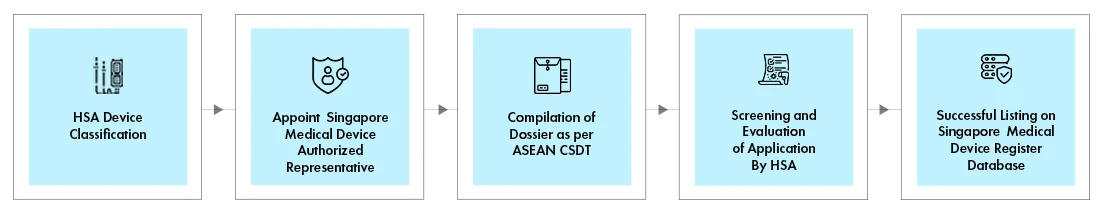
Il processo di registrazione dei dispositivi medici HSA si svolge attraverso il sistema online di informazione e comunicazione HSA dispositivi medici (MEDICS). La registrazione di ogni dispositivo HSA avviene attraverso un percorso di valutazione specifico, a seconda di quanto segue:
- Classificazione del rischio del dispositivo.
- Numero di approvazioni preventive rilasciate dalle agenzie regolatorie estere di riferimento.
- Durata della storia di sicurezza del dispositivo.
Il percorso di valutazione del dispositivo determinerà il Turn-Around-Time (TAT), le tariffe e i documenti necessari per la registrazione.
Registrazione di Classe A - I dispositivi medici di Classe A sono esenti dalla registrazione del prodotto. Tuttavia, è necessario compilare l'elenco delle esenzioni di Classe A in MEDICS durante la richiesta di licenza del rivenditore.
Flusso di processo
Gestione del ciclo di vita del dispositivo dopo l'approvazione
Freyr supporta i produttori esteri nella gestione End-to-end del ciclo di vita dei dispositivi medici, incluse le attività post-approvazione, quali:
- Gestione delle modifiche post-approvazione - modifiche alle approvazioni dei dispositivi medici esistenti, come l'aggiunta di nuove varianti e accessori; l'aggiunta di nuove indicazioni d'uso, tra le altre cose.
- Mantenimento delle approvazioni e della registrazione dei dispositivi medici attraverso il pagamento puntuale delle tasse amministrative e di registrazione.
- Rinnovo della licenza.
Con un team professionale per fornire supporto normativo, Freyr supporta i produttori nel mantenere la qualità e la sicurezza necessarie per l'approvazione. Gli esperti di intelligence di Freyr osservano attentamente gli aggiornamenti normativi e informano i clienti sui passi da intraprendere per la conformità dei prodotti agli standard prevalenti.
Sintesi
I tempi di elaborazione per la registrazione del prodotto sono indicati nella tabella seguente.
| Classe di rischio | Immediato | In tempi brevi | Abbreviato | Valutazione completa | Completo (Schema di revisione prioritaria) |
|---|---|---|---|---|---|
| Classe B | Registrazione immediata al momento dell'invio | 100 giorni lavorativi | 160 giorni lavorativi | 120 giorni lavorativi | |
| Classe C | Registrazione immediata al momento dell'invio (solo per applicazioni mobili mediche autonome di Classe C) | 120 giorni lavorativi | 160 giorni lavorativi | 220 giorni lavorativi | 165 giorni lavorativi |
| Classe D | 180 giorni lavorativi | 220 giorni lavorativi | 310 giorni lavorativi | 235 giorni lavorativi | |
| Classe D (dispositivi che incorporano prodotti medicinali) | 220 giorni lavorativi | 310 giorni lavorativi |
Il tempo di attesa per la modifica del dichiarante è di 40 giorni lavorativi.
NOTA -
- I dispositivi medici di classe A sono esenti dalla registrazione del prodotto.
- Il tempo di consegna non comprende il tempo necessario per rispondere a eventuali richieste di chiarimenti o informazioni aggiuntive da parte di HSA durante la fase di valutazione.
Competenza di Freyr
- Due Diligence normativa per la registrazione dei dispositivi presso l'HSA, Singapore
- Classificazione e raggruppamento dei dispositivi medici HSA
- Supporto per la valutazione dell'organismo di valutazione della conformità (CAB)
- Modello di dossier comune di presentazione ASEAN (CSDT) Compilazione di dossier
- Registrazione del dispositivo HSA ;
- Rappresentanza legale
- Supporto per l'etichettatura
- Identificazione e qualificazione dei distributori
- Sorveglianza post-marketing
- Gestione delle modifiche post-approvazione
- Rinnovo e trasferimento della licenza
- Servizi di presentazione e collegamento con l'HSA