BIMO, acronimo di Bioresearch Monitoring (Monitoraggio della Bioricerca), è un programma di ispezioni in loco e audit dei dati volto a monitorare tutti gli aspetti della conduzione e della rendicontazione della ricerca regolamentata dalla US Food and Drug Administration (FDA). Il programma è stato istituito nel 1977, in seguito all'esigenza di verificare i siti di ricerca clinica. L'obiettivo principale di questo programma è garantire la qualità e l'integrità dei dati presentati per le approvazioni di nuovi prodotti e le domande di commercializzazione. Inoltre, questo programma tutela anche i diritti e il benessere dei soggetti umani e animali coinvolti nella ricerca regolamentata dalla FDA.
Gli obiettivi principali del Programma BIMO
Ogni anno vengono condotte oltre 1000 ispezioni. Gli obiettivi principali del programma BIMO sono:
- Audit dei dati clinici
- Ispezione della ricerca clinica in corso
- Ispezione dei laboratori non clinici
- Ispezione delle commissioni di revisione istituzionale (IRB)
Quali prodotti rientrano nel campo di applicazione del BIMO Audit?
Il BIMO è applicabile a farmaci, prodotti biologici, dispositivi medici, prodotti alimentari, prodotti del tabacco e prodotti veterinari. Il programma di conformità è supervisionato dai sei (06) centri di prodotto della FDA: Centro per la valutazione e la ricerca sui biologici (CBER), Centro per i dispositivi e la salute radiologica (CDRH), Centro per la valutazione e la ricerca sui farmaci (CDER), Centro per la sicurezza alimentare e la nutrizione applicata (CFSAN), Centro per i prodotti del tabacco (CTP) e Centro per la medicina veterinaria (CVM).
Quali sono le aziende sottoposte a BIMO Audit?
Sia le aziende nazionali che quelle internazionali che svolgono o rientrano in una delle attività sotto elencate sono soggette ai requisiti del Monitoraggio della bioricerca.
- Laboratori di analisi non cliniche per la conformità alle Buone Pratiche di LaboratorioGLP)
- Sperimentatori clinici per la conformità alla Buona Pratica Clinica (GCP)
- Sponsor
- Organizzazioni di ricerca a contratto (CRO)
- Monitoraggio degli studi clinici
- Strutture per la bioequivalenza in vivo
- Commissioni di revisione istituzionale (IRB)
Quali programmi di conformità rientrano nel Programma BIMO?
FDA US FDA condurre un audit BIMO in qualsiasi momento attraverso i sette (07) programmi di conformità multicentrici. Questi sette programmi di conformità multicentrici sono implementati attraverso:
- Ispezione dello sperimentatore clinico (CI) e dello sperimentatore sponsor (SI)
- Ispezione del comitato di revisione istituzionale (IRB)
- Ispezione di organizzazioni di ricerca a contratto/sponsor/monitorCRO)
- Ispezione di buona pratica di laboratorioGLP)
- Ispezione della bioequivalenza-biodisponibilità (BEQ)
- Ispezione per la segnalazione delle esperienze avverse post-marketing (PADE)
- Ispezione dei rapporti di valutazione, mitigazione e strategia del rischio (REMS)
Ciascuno di questi programmi delinea un ambito dettagliato di revisione o ispezione da condurre per garantire la conformità con l'FDA.
Quali sono i regolamenti applicabili al BIMO Audit?
I regolamenti - 21 CFR 50 - Protezione dei soggetti umani, 21 CFR 54 - Divulgazione finanziaria, 21 CFR 56 - IRB, 21 CFR 58 - Buona pratica di laboratorio per i laboratori non clinici, 21 CFR 809 - Prodotti diagnostici in vitro e 21 CFR 812 - Esenzione per i dispositivi in fase di sperimentazione sono applicabili all'audit BIMO.
Quanti audit vengono svolti annualmente nell'ambito del Programma BIMO?
Il numero di audit BIMO condotti dallaFDA US FDA ogni anno. Negli ultimi anni, il numero di ispezioni in loco è diminuito a causa dell'inizio della pandemia di COVID-19 e la FDA dovuto sospendere tutte le attività di sorveglianza in loco degli studi clinici. Sono stati monitorati solo studi clinici specifici, critici e cruciali.
Le "valutazioni normative a distanza" (RRA) sono state introdotte durante la pandemia COVID-19 per monitorare a distanza la ricerca regolamentata. Le RRA sono condotte in videoconferenza e sono un'iniziativa volontaria per valutare a distanza i dati e i processi. Tuttavia, va sottolineato che le RRA non sono equivalenti o alternative alle ispezioni in loco, ma sono semplicemente una procedura che si è evoluta a causa della pandemia COVID-19.
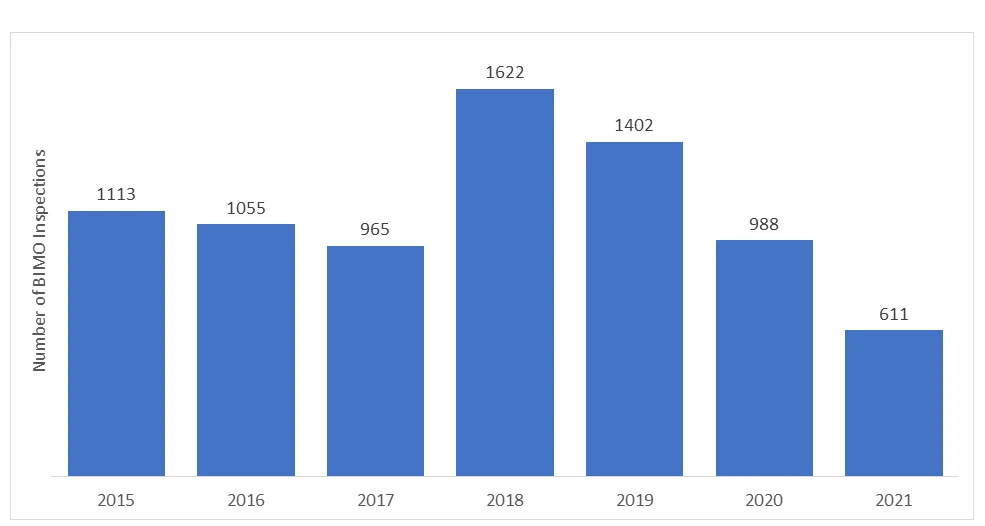
*I dati rappresentati per gli anni 2020 e 2021 non comprendono le ispezioni RRA.
Quante valutazioni normative a distanza (RRA) sono state condotte durante la pandemia COVID-19 nell'ambito del programma BIMO?
Nel 2021, l'adozione delle ispezioni RRA è aumentata significativamente in tutti i programmi. Nell'aprile 2021, l'FDA ha pubblicato un documento di orientamento su "Remote Interactive Evaluations of Drug Manufacturing and Bioresearch Monitoring Facilities During the COVID-19 Public Health Emergency Guidance for Industry", che fornisce informazioni esaustive sul processo di conduzione delle RRA da parte dell'FDA.
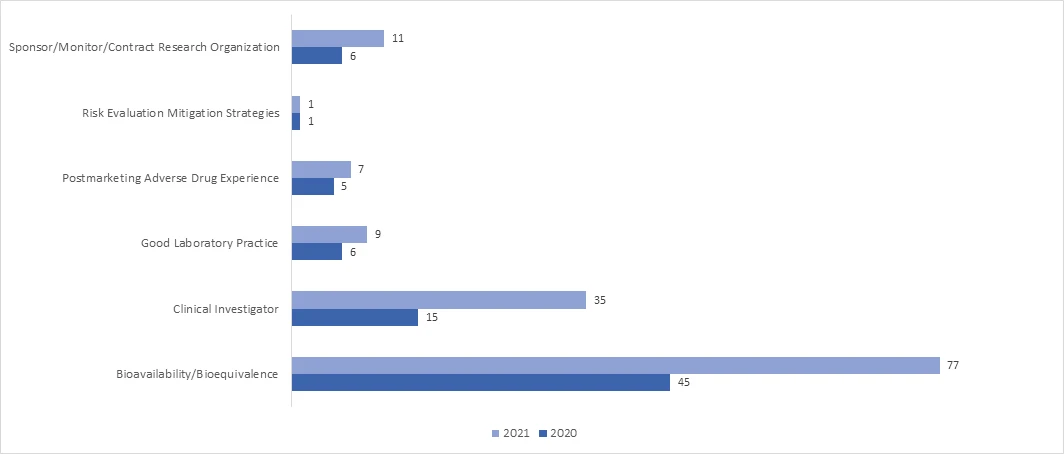
Quali sono i possibili risultati di un audit BIMO?
Durante l'audit BIMO, la US FDA può decidere di intraprendere una qualsiasi delle azioni elencate di seguito, in base alla conformità –
1. Nessuna azione indicata (NAI)
La NAI è applicabile quando l'ispettore sul campo dell FDA non ha identificato alcuna pratica discutibile o solo problemi minori per i quali non sono giustificate ulteriori azioni.
2. Azione volontaria indicata (VAI)
Il VAI è applicabile quando sono state identificate pratiche discutibili ma non significative.
3. Azione ufficiale indicata (OAI)
L'OAI è applicabile quando vengono identificate pratiche discutibili che compromettono l'integrità dei dati e/o i diritti dei soggetti umani.
Quali sono le non conformità più comuni emesse nell'ambito dell'audit BIMO?
Alcune delle non conformità più comuni osservate durante l'Audit BIMO sono...
- Non tenere una traccia corretta dei registri
- Fallimento rispetto al piano di sperimentazione
- Mancata osservanza dei regolamenti
- Mancato monitoraggio dei protocolli
- Protezione inadeguata dei soggetti
- Inadeguata responsabilità del prodotto oggetto di indagine
L'audit BIMO è cruciale per qualsiasi sviluppatore o produttore di nuovi dispositivi medici e tecnologie che intendono lanciare il loro dispositivo nel mercato US. Rispettare le normative e le linee guida per evitare qualsiasi delle insidie descritte è molto importante.
Avete bisogno di assistenza per quanto riguarda le ispezioni di audit BIMO? Reach Freyr. Rimanete informati. Rimanete conformi.