Ninsho (certificazione dei dispositivi medici) è un sistema di certificazione di terze parti in Giappone in cui un Organismo di Certificazione Registrato (RCB), accreditato dal Ministro della Salute, del Lavoro e del Welfare (MHLW), certifica dispositivi medici altamente controllati designati. È applicabile ai dispositivi di Classe II e a un numero limitato di dispositivi di Classe III che hanno uno standard industriale giapponese (JIS) associato. Alcuni dispositivi medici di Classe II senza criteri di certificazione stabiliti richiedono l'approvazione nell'ambito del programma Shonin.
Quali sono gli altri percorsi di registrazione dei dispositivi in Giappone?
In Giappone, per le approvazioni dei dispositivi medici vengono utilizzati anche i percorsi Todokede e Shonin, oltre al Ninsho. A seconda della categoria di rischio del dispositivo e della disponibilità di predicati in Giappone, il produttore deve pianificare attentamente la presentazione del dispositivo.
Quali sono i prerequisiti per la certificazione Ninsho?
I produttori che registrano i loro dispositivi tramite il percorso Ninsho devono pianificare meticolosamente le presentazioni in termini di quanto segue:
- Selezione di un RCB
- Invio di dati generali sul dispositivo, come la categoria del dispositivo medico, la destinazione d'uso, i dati dell'analisi dei rischi di efficacia, i dati clinici, ecc.
- Fornitura di una sintesi della documentazione tecnica (STED)
- I documenti devono essere forniti esclusivamente in lingua giapponese.
- I produttori stranieri devono obbligatoriamente nominare un Market Authorization Holder (MAH) o un Designated Market Authorization Holder (DMAH).
- I produttori stranieri devono registrarsi presso il MHLW e ottenere un certificato di Registrazione del Produttore Straniero (FMR) per i loro stabilimenti di produzione.
Cosa sono gli RCB?
Gli Organismi di Certificazione Registrati (RCB) sono organismi di certificazione di terze parti accreditati dal MHLW. Gli RCB sono responsabili della revisione e della certificazione dei dispositivi medici idonei e applicati secondo il percorso Ninsho. Gli RCB sono anche responsabili dell'esecuzione dell'audit QMS della struttura del produttore.
Quali sono i requisiti del SGQ per la registrazione dei dispositivi secondo il percorso Ninsho?
I produttori devono conformarsi a tutti i requisiti QMS definiti dall'Ordinanza 169. Il MAH o DMAH deve presentare la domanda agli RCB. Gli RCB effettueranno un'ispezione QMS dettagliata della struttura del produttore e, previa soddisfacente implementazione del QMS, rilasceranno il certificato.
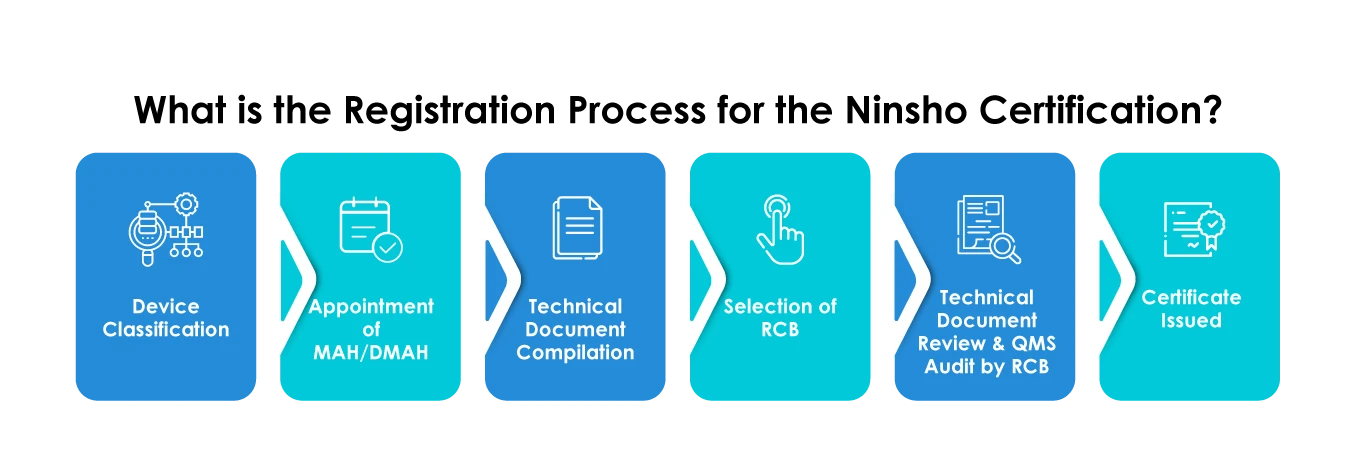
Qual è la tempistica media richiesta per la certificazione Ninsho?
L'RCB richiede in genere da tre (03) a cinque (05) mesi per completare la valutazione tecnica, eseguire l'audit del SGQ e rilasciare il certificato Ninsho.
C'è una scadenza per la certificazione Ninsho?
La registrazione dei dispositivi medici non ha scadenza, ma lo sponsor deve rinnovare i certificati QMS ogni cinque (05) anni.
Il Giappone, essendo il terzo mercato più grande per i dispositivi medici dopo gli STATI UNITI D'AMERICA e la Cina, offre grandi opportunità ai produttori di dispositivi medici di tutto il mondo. I produttori che desiderano commercializzare i loro dispositivi in Giappone devono pianificare attentamente la certificazione e l'approvazione dei dispositivi medici, poiché PMDA ha requisiti normativi specifici. I produttori possono optare per un partner normativo affidabile per un accesso senza problemi al mercato giapponese.
Per saperne di più sulla certificazione dei dispositivi medici in Giappone o su qualsiasi altra normativa PMDA Giappone, Contattate Freyr oggi!