I dispositivi medici innovativi sono essenziali per migliorare i risultati dell'assistenza sanitaria, rispondere alle esigenze mediche in evoluzione e fornire soluzioni economicamente vantaggiose per i pazienti e gli operatori sanitari. La strategia SAKIGAKE è un processo di revisione e approvazione accelerato per i dispositivi medici innovativi in Giappone. Questa strategia è stata avviata dal Ministero della Salute, del Lavoro e del Welfare giapponeseMHLW) nel 2015, con l'obiettivo di accelerare lo sviluppo e la commercializzazione di dispositivi medici innovativi in Giappone.
Nell'ambito della strategia SAKIGAKE, i dispositivi medici che soddisfano determinati criteri di innovazione possono ricevere una revisione e un'approvazione prioritaria da parte della Pharmaceuticals and Medical Devices AgencyPMDA), l'agenzia regolatoria responsabile delle approvazioni dei dispositivi medici in Giappone. I criteri di designazione per l'innovazione includono i seguenti:
- Dispositivi con un'efficacia di primo piano; si prevede che il dispositivo fornisca un beneficio clinico significativo con un meccanismo d'azione innovativo e un miglioramento radicale per i pazienti rispetto ai dispositivi medici esistenti.
- In primo luogo, il dispositivo è applicabile per le approvazioni in Giappone o contemporaneamente in Giappone e in altri Paesi.
- Il dispositivo ha il potenziale per rispondere a esigenze mediche non soddisfatte in Giappone. La patologia target deve essere grave, pericolosa per la vita o con sintomi persistenti.
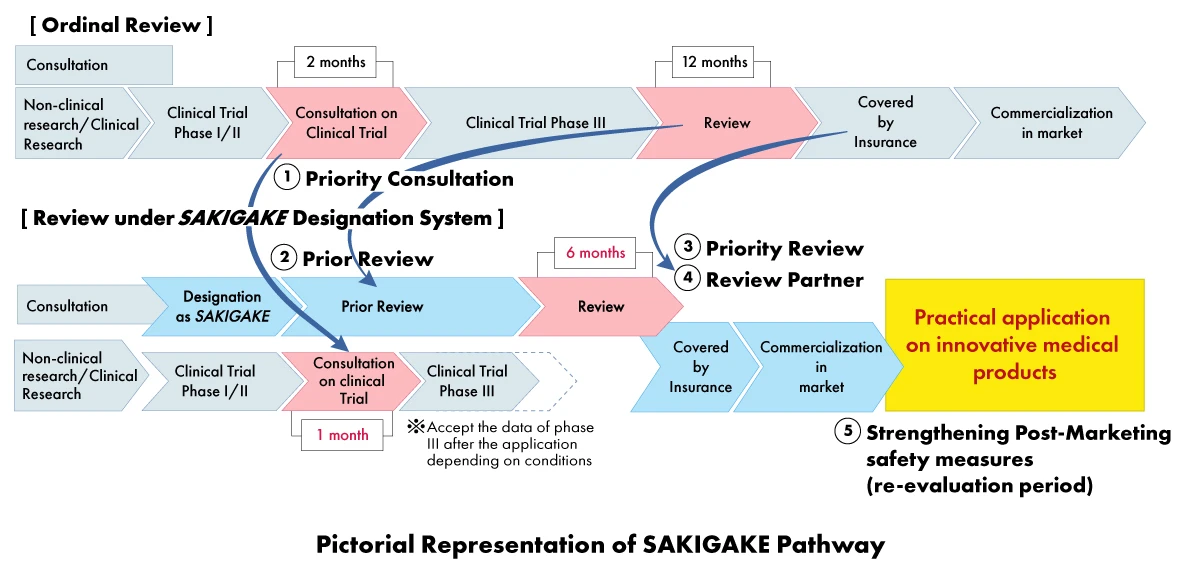
Nell'ambito della strategia SAKIGAKE, i produttori di dispositivi medici possono ricevere una serie di vantaggi, tra cui:
- Consultazione prioritaria: Riduzione del tempo di attesa per la consultazione degli studi clinici a un (01) mese.
- Revisione prioritaria: I prodotti designati SAKIGAKE ricevono una revisione prioritaria, con l'obiettivo di completare il processo di revisione entro sei (06) mesi invece di 12 mesi.
- Revisione efficace prima dell'applicazione: Incoraggiare la consultazione e accettare materiali in inglese.
- Partner di revisione dedicato: A ogni prodotto designato da SAKIGAKE viene assegnato un responsabile di revisione dedicato per l'intero processo di approvazione.
- Rafforzamento delle misure di sicurezza post-marketing: Estensione del periodo di riesame e facilitazione del collegamento con le società scientifiche.
Come fare domanda?
- Da parte del Richiedente: Il richiedente presenta la domanda alla Divisione Valutazione e Licenze (ELD) di PMDA .
- Da PMDA: ELD si sta avvicinando a un potenziale richiedente.
P.C- PMDA, Giappone.
Nel complesso, il sistema SAKIGAKE fornisce un percorso accelerato per lo sviluppo e l'approvazione di dispositivi medici innovativi in Giappone. L'obiettivo è migliorare i risultati per i pazienti e promuovere l'innovazione nel settore dei dispositivi medici. Il produttore deve consultare la PMDA nelle prime fasi del processo di sviluppo per discutere i requisiti normativi e ricevere un feedback sui piani di sviluppo del prodotto.
Per saperne di più sui percorsi di registrazione dei dispositivi medici in Giappone, reach subito un esperto di normative! Rimanete informati. Rimanete conformi.