Shonin (Approvazione Pre-Immissione in Commercio) è il percorso normativo per la registrazione dei dispositivi medici in Giappone. Il percorso Shonin è principalmente per la registrazione dei dispositivi medici di Classe II e III per i quali non sono disponibili gli standard di classificazione della PMDA. Anche per i dispositivi di Classe IV ad alto rischio, i produttori dovrebbero presentare la domanda Shonin. La PMDA è responsabile della revisione e dell'approvazione della domanda Shonin.
Quali sono gli altri percorsi di registrazione dei dispositivi in Giappone?
Oltre a Shonin, i percorsi Todokede e Ninsho sono utilizzati anche per le approvazioni dei dispositivi medici in Giappone. I produttori di dispositivi medici possono scegliere uno di essi a seconda della classe di rischio del dispositivo e della disponibilità di prodotti equivalenti in Giappone. Il produttore deve identificare la classificazione del dispositivo e ricercare la disponibilità dello Standard Industriale Giapponese (JIS) prima di determinare il percorso di registrazione applicabile.
- Todokede (Presentazione Pre-Commercializzazione) – È applicabile ai dispositivi di Classe I e richiede ai produttori di presentare una notifica pre-commercializzazione alla PMDA per l'approvazione.
- Ninsho (Certificazione pre-commercializzazione) - Si applica ai dispositivi generici di Classe II e III con standard di certificazione (standard JIS). L'organismo di certificazione registrato (RCB) è responsabile della revisione e dell'approvazione della domanda.
Quali sono i prerequisiti per la registrazione come Shonin?
I produttori che registrano i loro dispositivi tramite il percorso Shonin devono pianificare meticolosamente le presentazioni. Devono garantire quanto segue:
- Invio di dati generali sul dispositivo, come la categoria del dispositivo medico, la destinazione d'uso, i dati dell'analisi dei rischi di efficacia, i dati clinici, ecc.
- Fornitura di una sintesi della documentazione tecnica (STED)
- Fornitura di documenti solo in lingua giapponese
- I produttori stranieri devono obbligatoriamente nominare un Marketing Authorization Holder (MAH) o un Designated Marketing Authorization Holder (DMAH)
- I produttori stranieri devono ottenere il certificato di Registrazione del Produttore Straniero (FMR) per i loro stabilimenti di produzione.
Quali sono i requisiti del SGQ per la registrazione dei dispositivi secondo il percorso Shonin?
I produttori devono conformarsi a tutti i requisiti QMS definiti dall'Ordinanza 169. Lo sponsor o DMAH o MAH deve presentare domanda alla PMDA. La PMDA effettua un'ispezione QMS dettagliata della struttura del produttore e rilascia il certificato previa soddisfacente implementazione del QMS.
Qual è il processo di registrazione per l'approvazione del dispositivo secondo il percorso Shonin?
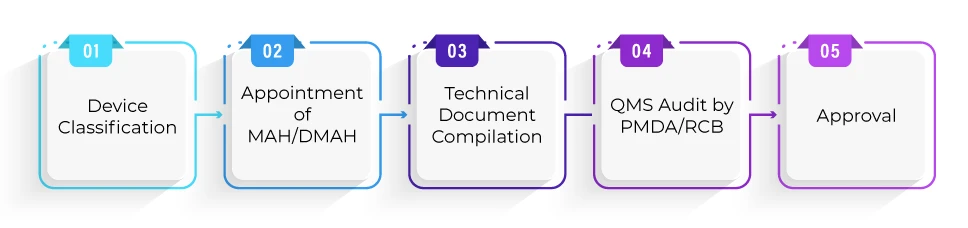
Qual è la tempistica media richiesta per l'approvazione del dispositivo secondo il percorso Shonin?
Il PMDA richiede solitamente 12 mesi per la valutazione tecnica a partire dalla data di ricezione della domanda Shonin. Il produttore deve considerare il tempo necessario per preparare i documenti di presentazione o per condurre gli studi clinici nelle tempistiche del progetto.
Esiste un calendario di scadenza per la registrazione dei dispositivi secondo il percorso Shonin?
La registrazione dei dispositivi medici non ha scadenza, ma lo sponsor deve rinnovare i certificati QMS ogni cinque (05) anni.
Il Giappone è un mercato redditizio ma intrinsecamente presenta complessità normative e barriere linguistiche. I produttori devono considerare questi fattori e pianificare proattivamente la loro strategia di ingresso nel mercato (GTM) per il Giappone. I produttori di dispositivi medici e IVD possono scegliere di esternalizzare tutte le sfumature normative a un partner normativo affidabile e utilizzare le risorse per concentrarsi su altri componenti essenziali.
Per saperne di più sull'approvazione dei dispositivi medici Shonin in Giappone o su qualsiasi altra normativa PMDA giapponese, contattate oggi stesso gli esperti di regolamentazionedi Freyr.