
Un regime di terapia farmacologica è diverso per i farmaci che possono essere approvati per essere utilizzati in combinazione con un farmaco precedentemente approvato o per lo sviluppo simultaneo di due nuovi farmaci, che aumentano sinergicamente l'efficacia. Le terapie antitumorali con un solo farmaco hanno messo in evidenza la resistenza ai farmaci come una delle principali minacce per i pazienti sottoposti a trattamenti con farmaci antitumorali. Considerando la diversità delle terapie di combinazione adottate per il trattamento del cancro, i regimi a due farmaci stanno gradualmente sostituendo la monoterapia come standard di cura per i pazienti. Nel corso del decennio, la terapia di combinazione ha fornito una migliore possibilità di trattamento.
Se siete un'organizzazione ben consapevole del cambiamento paradigmatico nello sviluppo dei farmaci antitumorali, passato dallo sviluppo di singoli farmaci a combinazioni innovative, saprete sicuramente che questo progresso ha portato a un aumento delle richieste di autorizzazione all'etichettatura incrociata da parte dei richiedenti. Riconoscendo le conversazioni, le ultime tendenze del settore e la sua attuale comprensione dei requisiti di uno sponsor, la US and Drug Administration (USFDA) US ha concesso una serie di linee guida per fornire supporto alle modifiche dell'etichettatura per i regimi farmacologici con prodotti farmaceutici precedentemente approvati.
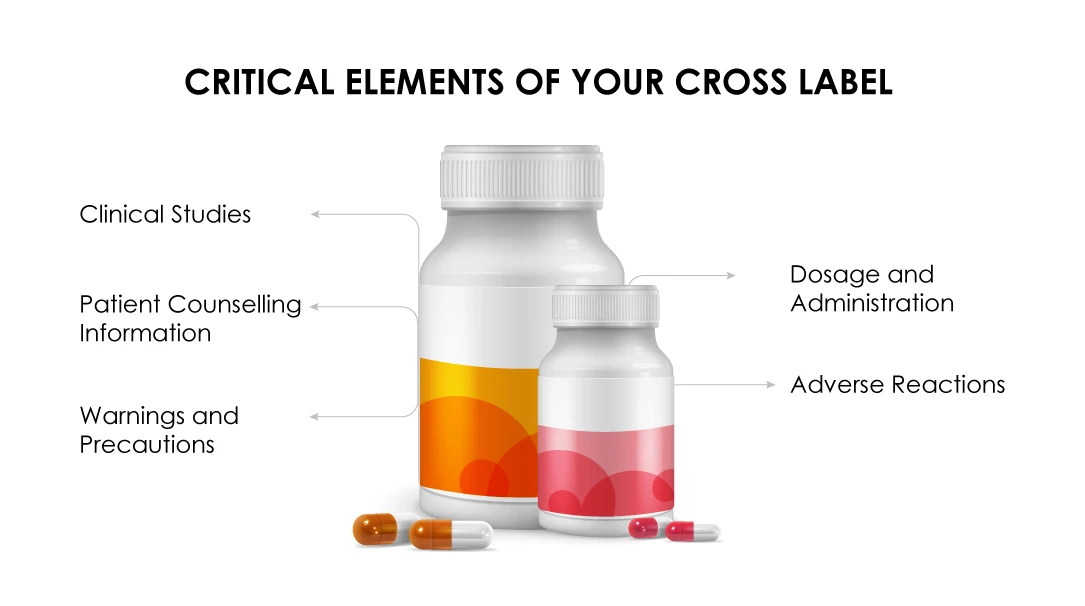
Congratulazioni! La vostra richiesta di guida all'etichettatura incrociata è stata accolta, se:
(a) L'indicazione per il regime combinato richiesto è approvata con un'indicazione analoga del farmaco.
(b) La sezione Dosaggio e somministrazione deve evidenziare il dosaggio raccomandato per il farmaco dello sponsor in un regime di associazione.
(c) I dati dello studio clinico devono giustificare i benefici dell'associazione per tutti i farmaci del regime.
(d) La sezione Avvertenzee precauzioni deve indicare l'unicità del regime di associazione sulla base di dati clinicamente significativi.
(e) Le reazioni avverse devono essere evidenziate come osservate negli studi clinici.
(f) Ilfoglietto illust rativo deve essere limitato alle sole tossicità previste dalla formulazione.
Le informazioni relative al solo farmaco dello sponsor devono occupare le restanti sezioni dell'etichetta, a meno che non sia necessario menzionare alcuni fattori farmacocinetici unici.
La guida approvata per l'etichettatura incrociata si rivolge specificamente ai prodotti per terapie antitumorali per affermare la comprensione fondamentale dell'etichettatura incrociata. Per aiutare gli sponsor a superare gli ostacoli operativi e normativi relativi alla modifica dell'etichetta, la guida afferma che:
- Linee temporali
I richiedenti devono proporre una bozza dei contenuti per l'etichettatura incrociata con una giustificazione basata su prove scientifiche del ruolo di ciascun prodotto menzionato nel regime terapeutico, nella loro proposta di etichettatura incrociata di un nuovo farmaco antitumorale in una BLA NDA BLA .
Si prevede che l'etichettatura incrociata venga identificata contemporaneamente per ogni farmaco del regime. Tuttavia, l'approvazione può essere concessa una dopo l'altra, in sequenza, a causa della diversa tempistica dei farmaci.
- Presentazione normativa
Ogni richiedente che desidera ottenere un'etichetta incrociata deve presentare una domanda originale o un supplemento di efficacia per l'etichettatura incrociata.
Il richiedente può scegliere di fare riferimento ai dati di altre applicazioni per giustificare i benefici sinergici del regime di combinazione.
Mentre si fa riferimento ai dati, il richiedente:
- deve garantire che i dati oggetto di riferimento incrociato siano già stati archiviati dalla FDA.
- deve annotare ogni sezione dei dati del richiedente che è oggetto di riferimenti incrociati.
- deve includere (sezione sottostante) solo le informazioni rilevanti per la droga del richiedente:
- AVVERTENZA IN SCATOLA (se applicabile)
- FORME DI DOSAGGIO E DOSAGGI
- CONTROINDICAZIONI
- INTERAZIONI TRA FARMACI
- USO IN POPOLAZIONI SPECIFICHE
- SOVRADOSAGGIO
- DESCRIZIONE
- FARMACOLOGIA CLINICA
- TOSSICOLOGIA NON CLINICA
- RIFERIMENTI
- MODALITÀ DI FORNITURA/STOCCAGGIO E MANIPOLAZIONE
L'etichettatura incrociata dei farmaci antitumorali può aiutare a informare i pazienti sul dosaggio, l'efficacia e i vantaggi dei risultati terapeutici. Con l'aumento esponenziale della terapia combinata come metodo standard, l'etichettatura incrociata può rivelarsi utile per migliorare o introdurre i metodi terapeutici attualmente in uso. Gli esperti di Freyr una profonda conoscenza delle sfide legate all'etichettatura dinamica e sono in grado di fornire soluzioni alle vostre domande in materia. Provate il miglior supporto professionale per l'etichettatura. Contattate Freyr!









