
Una comunicazione efficace ha sempre garantito la sicurezza e la qualità dell'assistenza per i pazienti. Nel corso degli anni, rimane un'esigenza insoddisfatta di fornire traduzioni delle etichette a individui che non parlano fluentemente l'inglese. La domanda di etichette di prodotti in più lingue regionali è cresciuta esponenzialmente, poiché i produttori farmaceutici intendono guidare il cambiamento verso la localizzazione e una migliore comunicazione.
Soddisfare queste richieste migliorerà la sicurezza del paziente e consentirà di soddisfare i requisiti normativi specifici del Paese. L'assenza di informazioni mediche importanti nei testi regionali comporta un ulteriore onere per i farmacisti e gli operatori sanitari che devono affrontare la barriera linguistica.
L'Health Products Regulatory Authority (HPRA) si occupa della conformità normativa in Irlanda. L'HPRA facilita e collabora con le parti interessate aderendo alle linee guida sulle migliori pratiche per l'etichettatura multilingue pubblicate dal Gruppo di Coordinamento per il Mutuo Riconoscimento e le Procedure Decentrate - Umani (CMDh). Inoltre, l'HPRA ha reso meno rigide alcune condizioni di etichettatura, tra cui:
- Uso di mL Irlanda (IE) rispetto a ml altri Stati dell'UE.
- Uso dei punti decimali nel volume o nella concentrazione del prodotto e del punto nell'IE rispetto alla virgola nell'UE. produttori di farmaci produttori superare questa discrepanza raggruppando il nome inventato, la concentrazione e la forma farmaceutica in un'unica unità in ciascuna lingua.
- Uso del separatore nell'intensità o nel volume del prodotto - Un punto nell'UE contro una virgola nell'IE. L'uso della virgola come separatore è consentito sulla confezione esterna immediata per evitare qualsiasi rischio di confusione nella popolazione di pazienti irlandesi.
- Le piccole unità di confezionamento immediato, cioè i contenitori di dimensioni inferiori o uguali a 50 ml, hanno uno spazio limitato e possono contenere le informazioni minime richieste, laddove giustificato, per più di due (02) lingue.
- Informazioni per i Paesi terzi - quando le condizioni delle informazioni sul prodotto sono simili nel Regno Unito e nei Paesi Bassi, le confezioni per più Paesi sono accettabili. Ulteriori requisiti specifici per il Paese sono inseriti in un "riquadro blu".
- Coordinamento della valutazione con gli altri Member States Le valutazioni simulate effettuate dagli Member States la conformità dell'etichettatura. I richiedenti possono coordinarsi con gli Member States ottenere chiarimenti sulle modifiche richieste prima della presentazione delle domande all'HPRA.
- Denominazioni congiunte - L'evidenziazione del nome inventato proposto agli Member States essere comunicata all'HPRA.
HPRA fornisce ulteriori suggerimenti per l'etichettatura multilingue:
- Le informazioni citate in inglese devono essere raggruppate in un blocco.
- Indicare i requisiti della "blue-box" per tutti i Paesi sullo stesso pannello quando più Paesi condividono un unico pacchetto.
- Le informazioni rivolte ai pazienti irlandesi devono essere chiaramente indicate in un codice ovale.
- I richiedenti possono includere una sezione perforata sulla confezione, a condizione che i dati rimovibili non siano in inglese. Questo deve essere indicato nella domanda.
- Al termine del processo, i richiedenti devono inviare all'HPRA un PDF del foglietto illustrativo per aggiornarlo sul sito web.
Criteri per un pacchetto multilingue:
- Il nome del prodotto e la sua forza devono essere uguali in tutte le lingue.
- Le informazioni riportate sull'etichetta e sul foglietto illustrativo devono essere conformi al riassunto delle caratteristiche del prodotto (SmPC).
- Le informazioni stampate sull'etichetta e sul foglietto illustrativo devono essere accurate e leggibili.
- Lo status giuridico del farmaco deve essere simile in entrambi i Paesi.
Un esempio di confezione multilingue potrebbe essere:
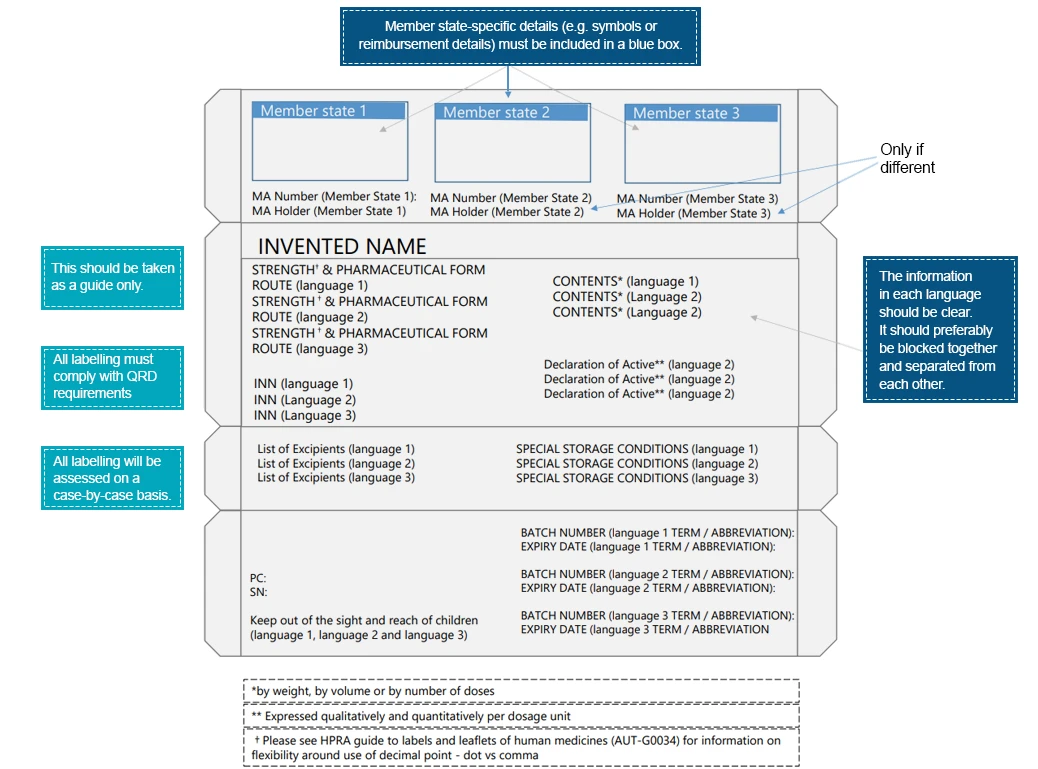
I pazienti interagiscono con le etichette dei farmaci molto prima di interagire con il prodotto farmaceutico stesso. Tali interazioni sottolineano ulteriormente l'importanza di trasmettere le informazioni essenziali attraverso i vari elementi presenti nell'etichetta del farmaco. Per garantire una migliore leggibilità e improvvisazione degli elementi dell'etichetta, le aziende farmaceutiche devono adottare le misure necessarie. Le lingue regionali forniscono un mezzo per trasmettere le istruzioni mediche relative al prodotto farmaceutico che garantiscono un uso sicuro ed efficace del prodotto prescritto. Esperti in materia di normative specifiche per ciascun Paese possono fornire assistenza nella traduzione delle informazioni riportate sulle etichette in conformità con le normative locali/regionali.Gli esperti Freyr sono ben attrezzati per fornire assistenza nel colmare il divario tra le informazioni mediche e la lingua. us un percorso di etichettatura conforme.









