
Lo sviluppo e l'approvazione dei farmaci per bambini è un aspetto fondamentale dell'assistenza sanitaria pediatrica. Tuttavia, a causa di considerazioni etiche e pratiche, gli studi clinici che coinvolgono i bambini sono spesso limitati. Di conseguenza, l'etichettatura dei farmaci pediatrici svolge un ruolo cruciale nel garantire un uso sicuro e appropriato dei farmaci in questa popolazione vulnerabile. In questo blog, confronteremo i requisiti di etichettatura dei farmaci pediatrici nell'Unione Europea (UE) e negli Stati Uniti (US) per comprendere meglio le somiglianze e le differenze tra questi due (02) quadri normativi.
Requisiti per l'etichettatura pediatrica nell'UE
L'EU ha requisiti specifici per l'etichettatura pediatrica dei prodotti medicinali. Questi requisiti garantiscono che i medicinali destinati ai bambini siano adeguatamente testati, autorizzati ed etichettati per fornire opzioni di trattamento sicure ed efficaci per i pazienti pediatrici.
Garantire la sicurezza dei farmaci pediatrici. Usattaci
Garantire ora la sicurezza dei farmaci pediatrici
Ecco alcuni aspetti dei requisiti di etichettatura pediatrica dell'UE:
- Piani di Indagine Pediatrica (PIP): Un PIP deve essere presentato all'Agenzia Europea per i Medicinali (EMA) prima che un medicinale possa essere approvato per i bambini. Esso delinea gli studi e i dati richiesti per valutare la sicurezza, l'efficacia e il dosaggio del medicinale nelle popolazioni pediatriche.
- Autorizzazione all'immissione in commercio per uso pediatrico (Pediatric Use Marketing Authorization, PUMA): se un farmaco è stato studiato nei bambini e soddisfa i requisiti richiesti, può ricevere una PUMA. Questa autorizzazione consente al farmaco di essere commercializzato per uso pediatrico.
- Formulazioni adatte all'età: I farmaci per uso pediatrico devono essere disponibili in formulazioni adatte alle diverse fasce d'età, come liquidi, compresse masticabili o dispositivi di dosaggio adatti all'età.
- Riepilogo delle Caratteristiche del Prodotto (SmPC) specifico per la pediatria: L'SmPC è un documento che fornisce informazioni dettagliate su un medicinale. Per i prodotti pediatrici, dovrebbe includere dettagli specifici sul dosaggio, la somministrazione e le considerazioni sulla sicurezza per le diverse fasce d'età.
- Avvertenze e precauzioni pediatriche: L'etichettatura deve includere qualsiasi avvertenza o precauzione specifica relativa all'uso del farmaco nei bambini, come potenziali effetti collaterali o interazioni con altri farmaci comunemente usati nei pazienti pediatrici.
- Monitoraggio e aggiornamenti continui: Una volta approvato un farmaco per uso pediatrico, possono essere richiesti studi successivi all'autorizzazione per raccogliere ulteriori dati sulla sua sicurezza ed efficacia. Questi possono portare ad aggiornamenti dell'etichettatura, se necessario.
Requisiti di etichettatura US
Negli US, la Food and Drug Administration (FDA) ha implementato il Pediatric Research Equity Act (PREA) e il Best Pharmaceuticals for Children Act (BPCA) per promuovere la ricerca e l'etichettatura dei farmaci pediatrici. Il PREA richiede alle aziende farmaceutiche di condurre studi pediatrici su determinati farmaci che potrebbero essere utilizzati nei bambini. Il BPCA concede sei (06) mesi aggiuntivi di esclusività di mercato alle aziende che conducono questi studi.
La FDA ulteriori linee guida per garantire la sicurezza, l'efficacia e il corretto dosaggio dei farmaci pediatrici come segue:
- Piani di studi pediatrici (PSP):produttori presentare piani che descrivono gli studi pediatrici per la valutazione della sicurezza e dell'efficacia dei farmaci.
- Informazioni specifiche per l'età: Le etichette devono includere il dosaggio specifico per l'età, le indicazioni e le considerazioni sulla sicurezza.
- Dosaggio basato sul peso: si suggerisce di assicurarsi sia basata sul peso.
- Reazioni avverse: Fornire le reazioni avverse e i dati di sicurezza specifici per l'età pediatrica.
- Formulazioni specifiche per l'età pediatrica: I farmaci possono richiedere forme di dosaggio specifiche per l'età pediatrica (ad esempio, liquidi e compresse masticabili).
- Ingegneria del fattore umano: Le etichette devono tenere conto della facilità di somministrazione per gli assistenti.
- Foglietti illustrativi per il paziente: Sono necessarie istruzioni chiare per la somministrazione, il dosaggio e gli effetti collaterali.
La tabella sottostante illustra le differenze e le analogie tra i requisiti di etichettatura US dell'Unione Europea:
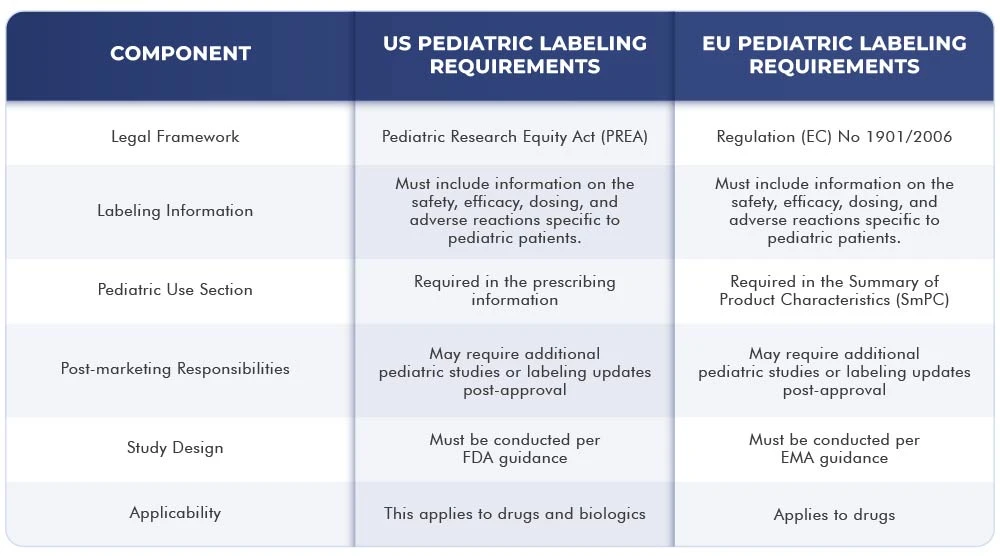
Conclusione
I requisiti di etichettatura dei farmaci pediatrici nell'UE e US a garantire un uso sicuro e appropriato dei medicinali nei bambini. Sebbene esistano somiglianze tra i due quadri normativi, come la necessità di studi pediatrici e l'inclusione di informazioni specifiche per la pediatria nell'etichettatura dei farmaci, vi sono anche differenze notevoli. Comprendere queste somiglianze e differenze è fondamentale per le aziende farmaceutiche, gli operatori sanitari e le autorità di regolamentazione al fine di garantire che i bambini abbiano accesso a farmaci sicuri ed efficaci.
Consultate un esperto di etichettatura comprovato come Freyr per la conformità ai requisiti di etichettatura specifici del paese.









