L'International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use (ICH) è un'organizzazione internazionale senza scopo di lucro che si impegna a mantenere un database aggiornato per riunire le Health Authority (HA) e i produttori farmaceutici al fine di discutere gli aspetti scientifici e tecnici del settore su un'unica piattaforma. Il Medical Dictionary for Regulatory Activities (MedDRA), di proprietà e sviluppato dall'ICH, è un dizionario normativo distinto e standardizzato che facilita la comunicazione delle informazioni normative a livello globale, senza interruzioni. Allo stesso modo, pioniere nella terminologia clinica, Systematized Nomenclature of Medicine (SNOMED) International è un'organizzazione senza scopo di lucro che mantiene il database di terminologia più completo al mondo, Systematized Nomenclature of Medicine -- Clinical Terms (SNOMED CT), che include oltre 350.000 concetti che spaziano tra diagnosi, segni e sintomi.
In uno studio pubblicato nel 2009 è stata analizzata la fattibilità dell'utilizzo di SNOMED CT come punto di ingresso per la codifica delle reazioni avverse ai farmaci e la loro mappatura automatica su MedDRA a fini di segnalazione e interoperabilità con archivi legacy. Comprendendo la portata di tale collaborazione, ICH SNOMED hanno annunciato congiuntamente il rilascio di nuove importanti mappe in ambito normativo e clinico. Gli sforzi collaborativi nell'ambito del progetto WEB-RADR 2 hanno portato al rilascio di due (02) importanti roadmap (da MedDRA a SNOMED CT e da SNOMED CT a MedDRA) che sono state strutturate intorno alla ripetibilità dell'uso dei termini e a ulteriori termini chiave di farmacovigilanza MedDRA identificati dall'Agenzia Europea per i Medicinali (EMA). Per promuovere la sicurezza dei farmaci, l'interoperabilità tra il database di farmacovigilanza (MedDRA) e le cartelle cliniche elettroniche (SNOMED CT) può aiutare a identificare possibili effetti collaterali e attivare contemporaneamente la segnalazione di eventi avversi. I dati raccolti attraverso tali segnalazioni possono essere utili per condurre ricerche epidemiologiche sulla demografia dei pazienti. Gli elementi chiave associati alla segnalazione di eventi avversi MedDRA potrebbero essere utilizzati per associare eventi avversi da farmaci, fornendo al contempo un "aiuto nel processo decisionale clinico".
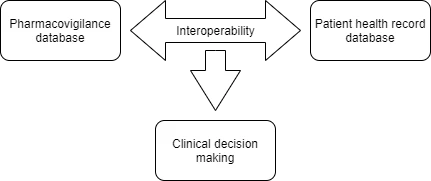
La versione di produzione delle due mappe viene messa a disposizione degli utenti SNOMED CT e MedDRA con licenza a partire dal 30 aprile 2021 e si baserà sulla versione di gennaio 2021 di SNOMED CT e sulla versione di settembre 2020 di MedDRA. È stato deciso che le mappe saranno rilasciate ogni anno nel mese di aprile.
Per accedere alle mappe:
- Per gli utenti autorizzati di MedDRA, visitare la pagina Download sul sito web di MedDRA.
- Gli utenti autorizzati di SNOMED CT visitano SNOMED International
I recenti aggiornamenti riguardanti l'interoperabilità stabilita tra il database di farmacovigilanza e le cartelle cliniche dei pazienti possono sembrare complessi da gestire. Tuttavia, i professionisti normativi esperti di Freyr possono fungere da unico punto di contatto per fornire supporto tecnico per il database della salute dei pazienti e le esigenze di miglioramento del processo decisionale clinico. Per migliorare la qualità dei risultati dei tuoi requisiti di Farmacovigilanza, forniamo assistenza per: ICSR, rapporti aggregati, servizi di Persona Qualificata Responsabile della FV (QPPV), servizi di Agente US, Rilevamento e Valutazione dei Segnali, Migrazione del Database, Riconciliazione degli Eventi Avversi e Servizi di Affiliato Locale e molto altro. Per esplorare le capacità End-to-End di Farmacovigilanza di Freyr, contattaci ora! Rimani informato. Rimani conforme.