Quando nel 2020 la pandemia di COVID-19 è stata riconosciuta per la prima volta come crisi sanitaria globale, le autorità sanitarie mondiali (HA) hanno adottato misure innovative per affrontarla nel miglior modo possibile. Allo stesso modo, le aziende farmaceutiche hanno messo a punto diversi vaccini/prodotti medicinali a beneficio della popolazione. Tuttavia, la registrazione dei prodotti si è rivelata piuttosto complessa. Per semplificare la registrazione, pur mantenendo la sicurezza, la qualità e l'efficacia, le autorità sanitarie hanno concesso autorizzazioni all'uso di emergenza (EUA) ad alcuni vaccini e prodotti correlati.
Ci si può chiedere come gli HA siano riusciti a garantire che i benefici di tali prodotti fossero superiori ai rischi. La risposta è l'adozione delle migliori pratiche di farmacovigilanza (FV).
Che cos'è la farmacovigilanza?
La FV è definita come un insieme di attività scientifiche legate all'individuazione, alla valutazione, alla comprensione e alla prevenzione degli effetti avversi e di qualsiasi altro problema legato ai farmaci. Di seguito è riportata una spiegazione figurativa di come funziona la FV e del processo che la caratterizza.
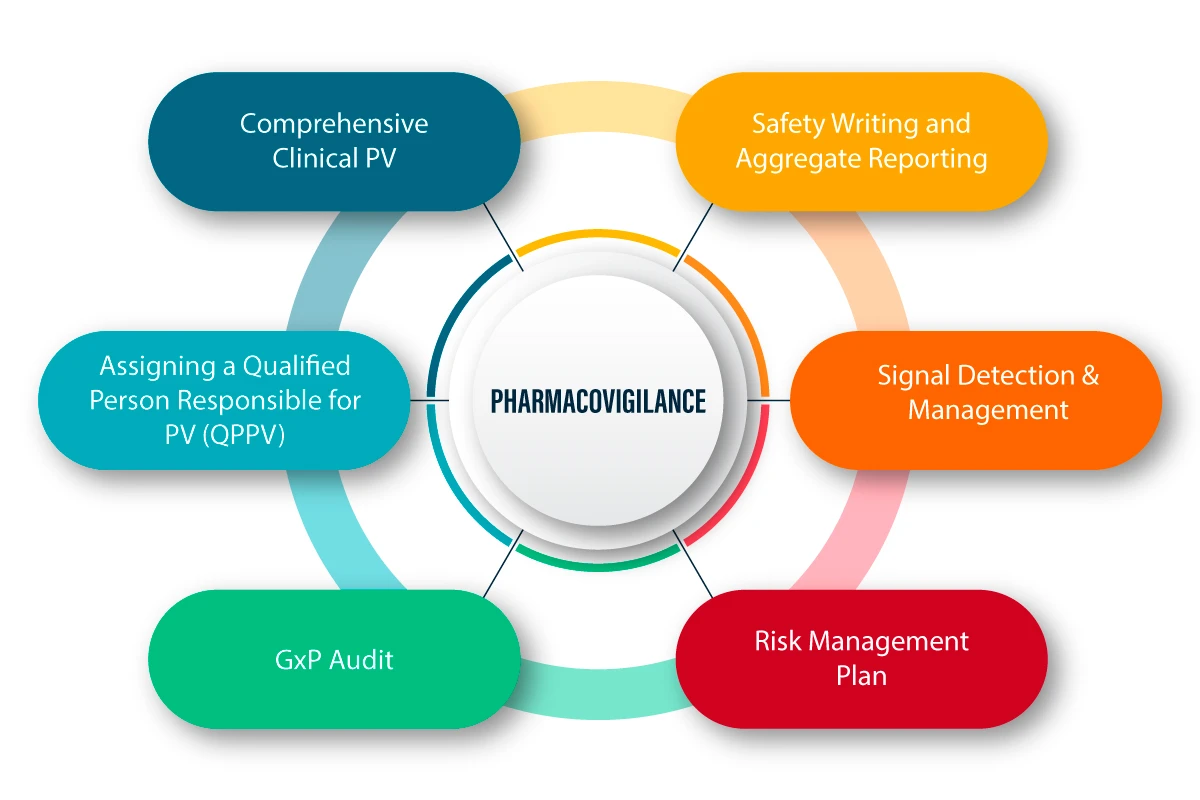
PV nella pandemia COVID-19
Quando la pandemia di COVID-19 ha iniziato a diffondersi in tutto il mondo, è stato necessario introdurre sul mercato vaccini e prodotti medicinali correlati in un periodo di tempo limitato, mantenendo gli standard di qualità richiesti. In tali scenari, durante la fase di sviluppo dei farmaci/vaccini erano disponibili meno soggetti per le sperimentazioni cliniche e il processo doveva essere completato più rapidamente del normale. Ciò potrebbe portare alla comparsa di alcuni effetti avversi nella fase successiva all'approvazione.
Pertanto, il rapporto rischi-benefici dei vaccini/medicinali è stato considerato fondamentale. Grazie alla comunicazione tempestiva delle reazioni avverse e degli effetti collaterali dannosi, l'efficacia dei prodotti è stata mantenuta in tempo reale.
Alcune delle principali attività di FV che hanno contribuito a mantenere la sicurezza, la qualità e l'efficacia di questi prodotti durante la pandemia sono le seguenti:
- Adottare un buon piano di gestione del rischio
- Valutazione del rischio con l'aiuto dei rapporti periodici di aggiornamento sulla sicurezza (PSUR).
- Raccolta dei dati di esposizione
- Studi di sicurezza post-autorizzazione (PASS)
- Segnalazione spontanea di sospette reazioni avverse
- Gestione efficace dei segnali
PV negli Affari Regolatori (RA)
È risaputo che il team di Affari Regolatori di un'azienda farmaceutica è responsabile della sicurezza e dell'approvazione dei nuovi prodotti. Gli specialisti RA si occupano delle attività di farmacovigilanza che si sono rivelate cruciali durante la pandemia, come:
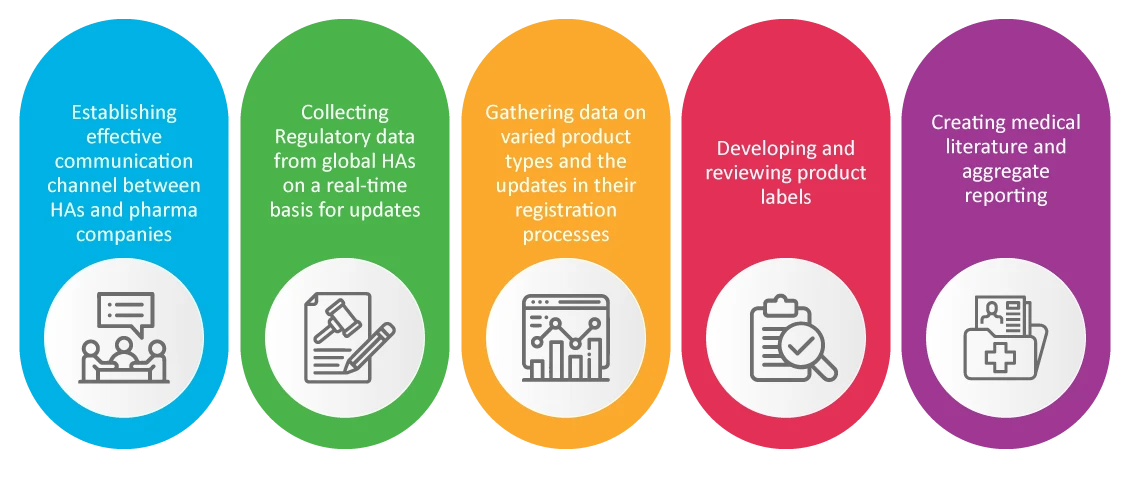
Conclusione
In conclusione, il PV aiuta a monitorare e segnalare la sicurezza di un prodotto farmaceutico. Grazie ai rapporti personalizzati sui casi individuali (ICSR), diventa più facile per produttori conformarsi alle rispettive normative delle autorità sanitarie globali. Siete alla ricerca di supporto normativo per la preparazione degli ICSR? Consultate un esperto di regolamentazione comprovato per la conformità. Reach Freyr.









