Negli ultimi anni, la pubblicità diretta ai consumatori (DTC) dei farmaci è diventata uno dei temi di discussione preferiti. A queste pubblicità, che si rivolgono ai consumatori piuttosto che agli operatori sanitari, è stato riconosciuto il merito di aver aumentato la consapevolezza dei pazienti e la richiesta di alcuni farmaci. Tuttavia, sono state anche criticate per aver potenzialmente portato a una sovradiagnosi e a un eccesso di trattamento.
Partecipando all'attuale corsa alle tendenze all'interno delle aziende farmaceutiche, è noto che la spesa totale per il marketing è superiore al loro budget per la ricerca. A livello globale, sono stati spesi 1,42 trilioni di dollari in tutto il mondo per il marketing. Negli Stati Uniti, nel 2021 sono stati spesi 486,62 miliardi di dollari per commercializzare farmaci ai medici; in Canada, nel 2022 sono stati spesi 29.305,1 milioni di dollari. Analizzando questi dati, il 56% era costituito da campioni gratuiti, il 25% da attività di "promozione" (promozione diretta dei farmaci) da parte dei rappresentanti farmaceutici presso i medici, il 12,5% da pubblicità diretta agli utenti, il 4% da attività di promozione presso gli ospedali e il 2% da pubblicità su riviste2. A volte le pratiche di marketing negative possono influire sia sui pazienti che sulla professione sanitaria.
Tipi di promozione dei farmaci
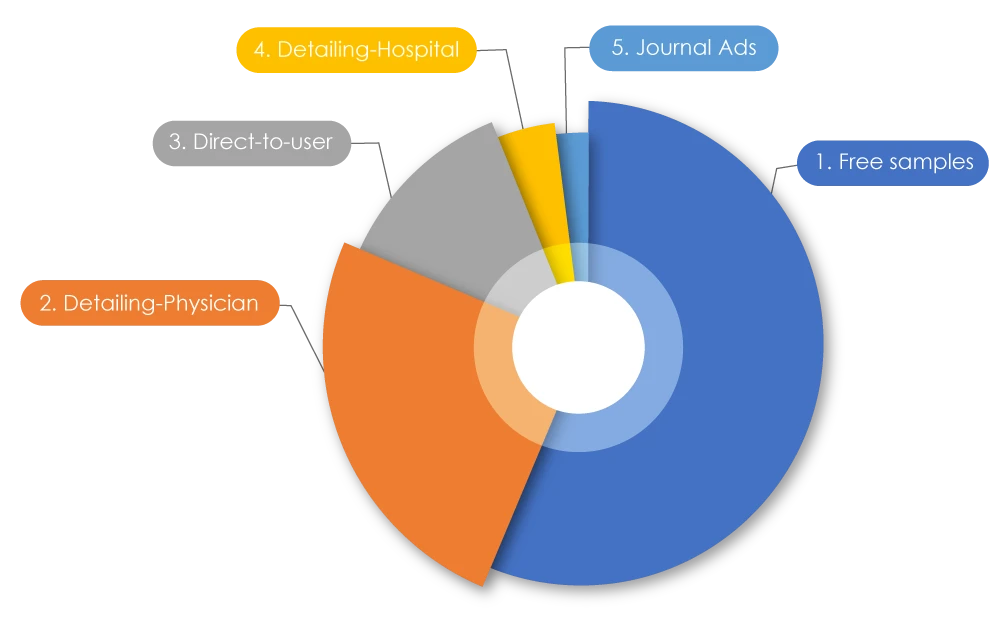
Fonte: Marketing farmaceutico - Wikiwand
Pubblicità farmaceutica al grande pubblico
La pubblicità al pubblico dei farmaci da prescrizione, comunemente chiamata anche pubblicità diretta al consumatore (DTC), è soggetta a restrizioni. Per promuovere i farmaci da prescrizione al pubblico, la comunicazione deve soddisfare alcuni requisiti fondamentali:
- La coerenza delle indicazioni riportate nelle pubblicità e nelle promozioni dei farmaci soggetti a prescrizione medica si basa sull'uso previsto per il quale il prodotto è stato approvato dalla FDA l'etichettatura FDA). L'etichettatura fornisce informazioni su come utilizzare il prodotto in modo sicuro ed efficace per l'indicazione approvata. Le pubblicità e le promozioni non coerenti con l'etichettatura FDA sono considerate promozioni illegali "off-label".
- La promozione e la pubblicità dei farmaci con obbligo di prescrizione richiedono un giusto equilibrio tra benefici e rischi del prodotto, assicurando che tali informazioni appaiano comparabili in termini di profondità, dettaglio e contesto.
- Le affermazioni devono essere supportate da prove o esperienze cliniche adeguatamente consistenti.
- Veritiero e non fuorviante - Se la pubblicità e la promozione dei farmaci da prescrizione sono false o fuorvianti in qualsiasi particolare, saranno considerate misbranded ai sensi della legge federale sugli alimenti, i farmaci e i cosmetici (FDCA) e saranno soggette ad applicazione.
- Utilizzo di un linguaggio adatto ai consumatori, evitando l'uso di linguaggio tecnico, termini scientifici e gergo medico nella pubblicità e nella promozione diretta ai consumatori. Deve attenersi all'etichettatura o alla monografia approvata del prodotto.
Informazioni contenute nella pubblicità farmaceutica per il pubblico in generale
La pubblicità e la promozione dei farmaci soggetti a prescrizione medica rivolte ai consumatori devono contenere i seguenti elementi fondamentali, come richiesto dalle normative FDCA e Food and Drug Administration (FDA).
- I nomi proprietari e consolidati devono essere quelli specificati nelle FDA .
- Dovrebbe includere la quantità di ingredienti del farmaco pubblicizzato
- Deve includere un "breve riassunto" che illustri ogni effetto collaterale, avvertenza, precauzione e controindicazione. Si concentra principalmente sulle informazioni importanti sui rischi piuttosto che su un elenco esaustivo dei rischi legati al prodotto. La maggior parte dei rischi è presentata in modo da essere compresa dai consumatori.
- I rischi principali del prodotto devono essere presentati in modo chiaro, evidente e neutrale come "dichiarazione principale".
- Le dichiarazioni informative relative agli eventi avversi per le pubblicità DTC devono includere la seguente dichiarazione MedWatch stampata in caratteri ben visibili: "Si invita a segnalare alla FDA gli effetti collaterali negativi dei farmaci soggetti a prescrizione medica. Visitare fda o chiamare il numero +1–800-FDA-10FDA.
- L'etichettatura e la pubblicità di richiamo sono esenti dai requisiti generali. È importante sottolineare che l'etichettatura e la pubblicità di richiamo non sono consentite per i farmaci soggetti a prescrizione medica con un'avvertenza in riquadro nell'etichettatura FDA.
Per la pubblicità dei farmaci DTC, Us
Per la pubblicità dei farmaci DTC
Restrizioni alle interazioni tra pazienti o organizzazioni di pazienti e industria
Le interazioni tra aziende farmaceutiche e pazienti/organizzazioni di pazienti sono consentite solo in alcuni paesi, come gli Stati Uniti, ma con limitazioni, come ad esempio:
- Deve essere on-label/CFL
- Equilibrato
- Adeguatamente motivato e
- Non è altrimenti falso o fuorviante
Inoltre, le interazioni con i clienti non devono implicare lo Statuto Anti-Kickback inducendo le organizzazioni di pazienti o i pazienti a raccomandare o utilizzare il prodotto pubblicizzato.
Nel Regno Unito, la pubblicità DTC al pubblico è consentita per i prodotti farmaceutici, ma esclude i bambini. È vietata la pubblicità al pubblico di farmaci soggetti a prescrizione medica. Le pubblicità devono includere il nome del prodotto e il nome dell'ingrediente attivo. Non sono consentiti campioni di prodotti o buoni che consentano ai consumatori di ottenere il prodotto gratuitamente o a un prezzo irragionevolmente basso.
In Germania, la pubblicità al pubblico è consentita per i prodotti farmaceutici esclusivamente per i bambini di età inferiore ai 14 anni. La pubblicità al pubblico di medicinali soggetti a prescrizione è vietata. Esistono però anche regole speciali per la pubblicità dei prodotti medicinali al di fuori degli ambienti professionali. Queste regole speciali sono principalmente stabilite nella Legge sulla pubblicità dei medicinali (Heilmittelwerbegesetz, "HWG") e sono state modificate dalla Legge tedesca sui prodotti farmaceutici (Arzneimittelgesetz – "AMG") per essere in linea con la Direttiva 2001/83/CE4.
Discussione sulla possibilità della pubblicità dei farmaci nell Era digitale
I sostenitori della pubblicità dei farmaci DTC sostengono che essa conferisce ai pazienti il potere di informarsi sulle opzioni terapeutiche. Inoltre, sottolineano che può portare a un aumento della domanda di farmaci, con conseguenti vantaggi per le aziende farmaceutiche.
D'altro canto, i critici della pubblicità dei farmaci DTC sostengono che può portare a una sovradiagnosi e a un eccesso di trattamenti. Sostengono che queste pubblicità spesso esagerano i benefici dei farmaci e ne sminuiscono i rischi, inducendo i pazienti a chiedere al medico farmaci di cui potrebbero non avere bisogno. Inoltre, affermano che può portare a un aumento dei costi sanitari, in quanto ai pazienti possono essere prescritti farmaci di marca più costosi piuttosto che alternative generiche più economiche.
Nonostante il dibattito in corso, la pubblicità di farmaci DTC è destinata a rimanere. La FDA ha emesso linee guida per questo sottotipo di pubblicità, che includono requisiti per la divulgazione dei rischi e un giusto equilibrio tra benefici e rischi. In conclusione, la pubblicità di farmaci DTC ha il potenziale per educare i pazienti e aumentare la domanda di determinati farmaci. Tuttavia, è anche importante considerare i potenziali svantaggi ed essere consapevoli dei limiti delle informazioni fornite in queste pubblicità. Come sempre, è importante consultare il proprio medico prima di assumere qualsiasi farmaco. Contattate gli esperti Freyr per una conformità End-to-End!