
Le etichette dei farmaci fungono da guida di prima mano per gli utenti e aiutano a utilizzare i prodotti in modo qualitativo. Pertanto, è molto importante che le informazioni disponibili sulle etichette siano coerenti, di facile lettura, prive di errori e in linea con gli standard globali. Per allinearsi a questi standard, la Therapeutic Goods Administration (TGA) ha introdotto alcune modifiche nel modo in cui le informazioni di etichettatura vengono presentate sui prodotti. Lo scopo dell'introduzione di queste modifiche è quello di migliorare la chiarezza e la coerenza delle informazioni fornite agli operatori sanitari.
Quali sono le nuove modifiche alle etichette?
Sebbene le nuove informazioni siano già state prese in considerazione e implementate per produttori, è opportuno conoscerle nel dettaglio per una presentazione completa. Di seguito sono elencate alcune di esse, su cui i produttori lavorare quando definiscono le etichette dei loro medicinali.
1. Informazioni sull'ingrediente attivo
Secondo la nuova norma, gli ingredienti attivi devono essere:
- Collocazione più evidente sul lato anteriore della confezione del farmaco
- Deve essere collocato sotto o accanto al nome del medicinale sul fronte della confezione del farmaco
- Deve essere facilmente comparabile tra i farmaci
2. Informazioni sui farmaci
Per garantire che gli utenti e gli operatori sanitari prendano una decisione informata, le informazioni sui farmaci devono essere più chiare in termini di:
- Informazioni sanitarie critiche nelle etichette distintive
- Tutte le informazioni obbligatorie devono essere presentate in modo più chiaro e riconoscibile rispetto al colore di sfondo per migliorarne la leggibilità.
- Le sostanze dichiarabili, come gli allergeni, devono essere indicate in etichetta.
3. Informazioni sanitarie critiche
Le informazioni critiche sulla salute aiutano i consumatori a utilizzare il farmaco in modo sicuro, fornendo informazioni importanti. Le informazioni presenti nella tabella delle informazioni critiche sulla salute sono sempre nello stesso ordine, anche se la rappresentazione delle informazioni può essere leggermente diversa. Le informazioni critiche sulla salute presentano le seguenti voci e informazioni nello stesso ordine:
- Principi attivi: Nome del principio attivo e sua quantità
- Indicazioni: Uso del farmaco
- Avvertenze: Include le avvertenze, i consigli e le avvertenze supplementari sull'uso del medicinale alla voce "Istruzioni per l'uso".
- Istruzioni per l'uso: include informazioni sull'uso sicuro del farmaco.
- Altre informazioni: Include informazioni come i dettagli di conservazione, le caratteristiche anti-manomissione, i dettagli di contatto dello sponsor, l'elenco degli ingredienti, ecc. Questa parte potrebbe non comparire su tutti i farmaci
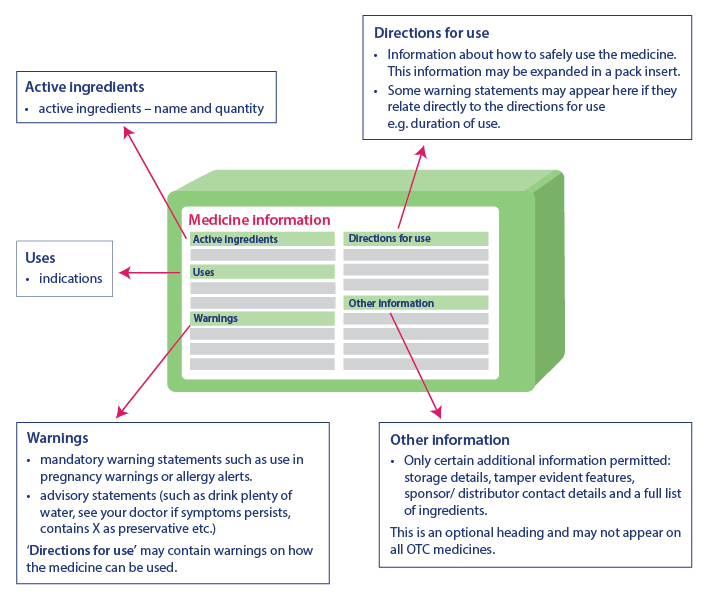
Fonte: TGA
4. Dispensazione in farmacia
Secondo la nuova norma, i dispensatori di farmaci subiscono le seguenti modifiche:
- Per migliorare l'identificazione dei farmaci, i cartoni dei medicinali soggetti a prescrizione devono riportare il nome sui tre lati non contrapposti.
- Le etichette dei medicinali soggetti a prescrizione medica devono avere uno spazio dedicato di 70x30 millimetri, a meno che non siano forniti in una confezione primaria o in una confezione iniziale.
5. Informazioni sugli allergeni
I farmaci devono riportare sull'etichetta le seguenti informazioni:
- Se presenti nel farmaco, tutte le sostanze devono essere dichiarate in etichetta.
- Ulteriori sostanze, come crostacei, pesce, uova, soia, latte e noci, devono essere dichiarate in etichetta.
- Nel caso di nuovi allergeni, i produttori potrebbero non includerli fino alla fine del periodo di transizione di 4 anni
Sebbene la TGA abbia pubblicato queste informazioni per gli operatori sanitari, riteniamo che anche produttori abbiano l'obbligo fondamentale di etichettare i propri prodotti in modo completo. In questo modo, gli operatori sanitari possono consultare le informazioni aggiornate senza alcuna confusione e guidare i pazienti verso un consumo sicuro. È noto che la TGA ha concesso ai produttori periodo di transizione di quattro anni per attuare queste modifiche. Dopo la data stabilita, le etichette dei medicinali dovranno essere conformi ai nuovi requisiti di etichettatura. Rimanete informati. Rimanete conformi.









