
La ricerca clinica è una pietra miliare del progresso medico, in quanto fornisce le prove necessarie a sostenere la sicurezza e l'efficacia di nuovi trattamenti e interventi. Il cuore di questa ricerca è il protocollo di sperimentazione clinica, un documento che delinea gli obiettivi, il disegno, la metodologia e l'organizzazione di uno studio clinico. Lo sviluppo di un protocollo di sperimentazione clinica solido è fondamentale e la revisione paritaria svolge un ruolo essenziale nel garantirne la validità scientifica e l'integrità etica.
Comprendere i protocolli degli studi clinici
Un protocollo di sperimentazione clinica non è solo un progetto per la conduzione di una ricerca; è un contratto tra gli sperimentatori, gli sponsor e gli enti regolatori. Descrive in dettaglio ogni aspetto dello studio, dall'ipotesi e dagli obiettivi ai criteri di eleggibilità, alle procedure e al piano di analisi statistica. Il protocollo deve affrontare le questioni di sicurezza, le considerazioni etiche e la fattibilità generale dello studio.
Il ruolo della Peer Review
La revisione paritaria è un processo essenziale in cui gli esperti del settore valutano criticamente il protocollo della sperimentazione clinica prima dell'inizio dello studio. Questo esame serve a diversi scopi fondamentali:
- Garantire il rigore scientifico: I revisori paritari valutano il razionale scientifico alla base dello studio, la chiarezza del quesito di ricerca e l'adeguatezza della metodologia. Si assicurano che il disegno dello studio sia in grado di rispondere al quesito di ricerca e che il piano di analisi statistica sia adeguato per interpretare i risultati.
- Protezione della sicurezza dei partecipanti: I revisori valutano i potenziali rischi e benefici per i partecipanti, assicurando che le misure di sicurezza siano in atto e che la sperimentazione aderisca agli standard etici. Confermano che i diritti, la sicurezza e il benessere dei soggetti dello studio sono prioritari rispetto agli interessi della scienza e della società.
- Aumento della credibilità: Un protocollo sottoposto a una rigorosa revisione paritaria guadagna credibilità tra le parti interessate, comprese le autorità di regolamentazione, i comitati etici e i potenziali partecipanti. Dimostra un impegno alla qualità e all'integrità del processo di ricerca.
- Facilitare l'approvazione regolatoria: Gli enti regolatori spesso richiedono la prova della revisione paritaria come parte del processo di richiesta di sperimentazione clinica. Un protocollo ben revisionato ha maggiori probabilità di soddisfare i severi requisiti per l'approvazione dello studio e la successiva registrazione del farmaco o del dispositivo.
- Promuovere la collaborazione: La revisione paritaria incoraggia la collaborazione e la condivisione delle conoscenze tra i ricercatori. Può portare all'identificazione di potenziali problemi e all'incorporazione di suggerimenti che rafforzano il protocollo.
Il processo di Peer Review
Il processo di peer review prevede in genere le seguenti fasi:
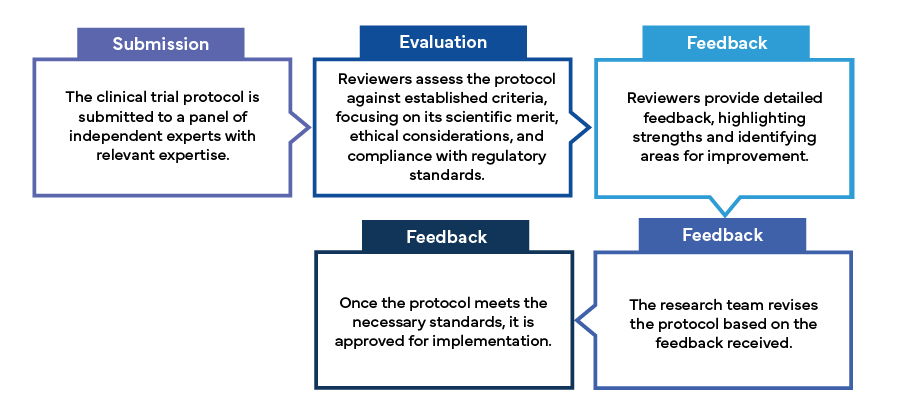
Conclusione
La revisione tra pari è un pilastro fondamentale nello sviluppo dei protocolli di studi clinici, garantendo rigore scientifico, sicurezza dei partecipanti e conformità normativa. Collaborare con Freyr Solutions per i servizi di revisione tra pari offre ulteriori vantaggi, incluso l'accesso a un team di professionisti esperti con diverse competenze negli affari regolatori, nella scrittura medica e nella ricerca clinica. L'approccio collaborativo di Freyr e il suo impegno per la garanzia della qualità possono aiutare a semplificare il processo di revisione tra pari, accelerare l'approvazione del protocollo e migliorare il successo complessivo degli studi clinici.









