
L'intercambiabilità con un prodotto biologico di riferimento è un passo fondamentale nel processo di approvazione dei biosimilari. Essa garantisce che un biosimilare possa sostituire il prodotto di riferimento senza alcun rischio significativo di riduzione dell'efficacia o aumento dei rischi per la sicurezza. Questo blog cerca di comprendere gli ultimi FDA sulle considerazioni per ottenere l'intercambiabilità e le migliori pratiche del settore per raggiungere l'eccellenza normativa.
Definire l'intercambiabilità
Ottenere l'intercambiabilità è un processo complesso e rigoroso che richiede il rispetto di severi requisiti normativi. La sfida consiste nel dimostrare che il biosimilare non solo corrisponde al prodotto di riferimento in termini di sicurezza ed efficacia. sicurezza ed efficacia ma anche che fornisce gli stessi risultati clinici in un determinato paziente. Il mancato rispetto di questi requisiti può comportare ritardi o dinieghi nell'approvazione, con ripercussioni sull'accesso al mercato e sulla cura dei pazienti.
Requisiti normativi per l'intercambiabilità
La FDA criteri specifici per dimostrare l'intercambiabilità nei suoi documenti guida. Tali criteri includono:
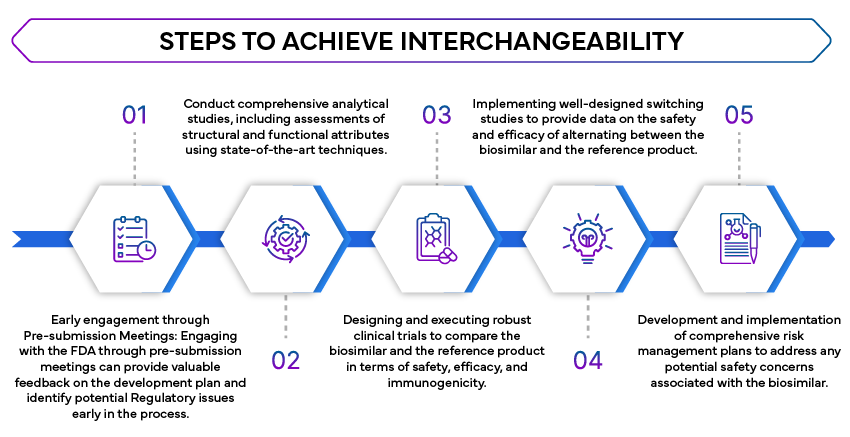
- Studi analitici comparativi: Sono necessari studi analitici approfonditi per dimostrare che il biosimilare è altamente simile al prodotto di riferimento. Questi studi valutano la struttura molecolare, la funzione e la composizione del biosimilare.
- Studi clinici: Gli studi clinici sono necessari per confermare che il biosimilare non presenta differenze clinicamente significative rispetto al prodotto di riferimento in termini di sicurezza, purezza e potenza. Spesso si tratta di studi comparativi di farmacocinetica (PK) e farmacodinamica (PD).
- Studi di commutazione: la FDA studi di commutazione per valutare l'impatto dell'alternanza tra il prodotto biosimilare e il prodotto di riferimento. Questi studi sono fondamentali per garantire che la commutazione non influisca sull'efficacia o sulla sicurezza del trattamento.
- Strategie di valutazione e mitigazione del rischio (REMS): se applicabile, le REMS devono essere prese in considerazione per garantire che il biosimilare possa essere utilizzato in modo intercambiabile senza ulteriori problemi di sicurezza.
Passi per ottenere l'intercambiabilità in modo strategico
Il ruolo di un partner normativo
Le partnership regolatorie possono aumentare significativamente la probabilità di ottenere l'intercambiabilità. Ecco come può essere d'aiuto un partner regolatorio:
- Guida di esperti: Fornisce consulenza esperta sui requisiti normativi e sulle strategie per soddisfare le linee guida della FDA.
- Supporto alla documentazione: Assistenza nella preparazione di documenti di presentazione di alta qualità conformi agli standard normativi.
- Progettazione di studi clinici: Supporta la progettazione e l'esecuzione di solidi studi clinici e di commutazione.
- Interazioni con l'HA: Facilita una comunicazione efficace con l'HA, assicurando un feedback tempestivo e costruttivo.
- Gestione del rischio: Sviluppare strategie complete di gestione del rischio per ridurre i potenziali problemi di sicurezza.
I vantaggi di avere un partner normativo
| Vantaggi | Descrizione | |
| 1. | Competenza nei requisiti normativi | Profonda conoscenza del panorama normativo e dei requisiti globali. |
| 2. | Documentazione semplificata | Assicura una preparazione accurata e conforme della documentazione. |
| 3. | Processo di presentazione efficiente | Riduce tempi e costi grazie a una gestione efficiente delle richieste. |
| 4. | Conformità migliorata | Riduce al minimo il rischio di ritardi e rifiuti grazie a un'accurata conformità. |
| 5. | Gestione efficace del rischio | Identificazione e mitigazione proattiva dei rischi potenziali. |
Sintesi
Il raggiungimento dell'intercambiabilità con un prodotto di riferimento è un processo impegnativo ma essenziale per il successo dell'approvazione dei biosimilari. Richiede una comprensione completa dei requisiti regolatori, una pianificazione meticolosa e dati clinici solidi. La collaborazione con un fornitore di servizi regolatori esperto può aumentare notevolmente le possibilità di successo, garantendo che il biosimilare soddisfi i rigorosi criteri stabiliti dalle autorità regolatorie. Grazie a una guida esperta, a una documentazione accurata e a una gestione strategica del rischio, gli sponsor possono percorrere il complesso percorso verso l'intercambiabilità in modo più efficace.









