
Negli ultimi anni, il panorama degli affari regolatori ha subito una significativa trasformazione. Al centro di questo cambiamento c'è una crescente enfasi sulla centralità del paziente, con le autorità sanitarie (HA) di tutto il mondo che riconoscono il ruolo inestimabile che i pazienti svolgono nello sviluppo e nell'approvazione di nuovi prodotti medicinali. Questo cambiamento non è solo una tendenza; è una rivisitazione fondamentale di come affrontiamo le sottomissioni regolatorie e, in ultima analisi, di come serviamo coloro che contano di più – i pazienti.
Il problema:
Tradizionalmente, le presentazioni normative si concentravano principalmente sul soddisfare i requisiti tecnici e scientifici, spesso trascurando l'impatto diretto sulle esperienze e sui risultati dei pazienti. Questo approccio, sebbene approfondito, a volte non riesce a cogliere le sfumature delle esigenze, delle preferenze e dell'uso nel mondo reale dei prodotti medicinali da parte dei pazienti. Di conseguenza, c'era una disconnessione tra le approvazioni normative e il valore effettivo fornito ai pazienti.
Approcci normativi incentrati sul paziente:
Le autorità sanitarie, in particolare la FDA EMA, hanno compiuto passi significativi nell'integrare il punto di vista dei pazienti nei loro quadri normativi.
Questo approccio orientato al paziente è evidente in diverse aree chiave:
- Sviluppo di farmaci incentrato sul paziente (PFDD):
Il programma PFDD FDA è un'iniziativa innovativa che raccoglie sistematicamente i contributi dei pazienti per informare lo sviluppo dei farmaci e il processo decisionale normativo. Questo programma include sessioni di ascolto dei pazienti, incontri pubblici e lo sviluppo di documenti guida per migliorare il coinvolgimento dei pazienti durante tutto il ciclo di vita del prodotto. - Prove del mondo reale (RWE):
È sempre più riconosciuto il valore dei dati reali per comprendere le prestazioni di un prodotto in diverse popolazioni di pazienti. Gli HA sono ora più aperti a prendere in considerazione le RWE nelle proposte regolatorie, che forniscono una visione più completa dei benefici e dei rischi di un prodotto. - Risultati riferiti dai pazienti (PRO):
L'inclusione dei PRO negli studi clinici e nelle richieste di autorizzazione è diventata sempre più importante. Queste misure catturano direttamente l'esperienza del paziente, fornendo preziose informazioni sui sintomi, sulla qualità della vita e sulla soddisfazione per il trattamento. - Coinvolgimento precoce e consulenza scientifica:
Le autorità sanitarie incoraggiano gli sponsor a impegnarsi fin dalle prime fasi del processo di sviluppo, includendo spesso i rappresentanti dei pazienti in queste discussioni. Questo dialogo precoce aiuta ad allineare i piani di sviluppo alle esigenze dei pazienti e alle aspettative delle autorità regolatorie. - Coinvolgimento dei pazienti nella valutazione dei rischi e dei benefici:
Sia la FDA EMA sviluppato dei quadri di riferimento per integrare il punto di vista dei pazienti nella valutazione dei rischi e dei benefici, garantendo che le decisioni normative riflettano ciò che è più importante per i pazienti.
Tabella: Principali iniziative centrate sul paziente da parte delle principali autorità sanitarie
| Autorità sanitaria | Iniziativa | Descrizione |
|---|---|---|
| FDA | Sviluppo di farmaci incentrato sul paziente (PFDD) | Approccio sistematico alla raccolta dei contributi dei pazienti |
| EMA | Gruppo di lavoro pazienti e consumatori (PCWP) | Forum per il dialogo con le organizzazioni di pazienti e consumatori |
| MHRA | Coinvolgimento dei pazienti e del pubblico | Strategia di coinvolgimento dei pazienti nei processi regolatori |
| Health Canada | Quadro di riferimento per il coinvolgimento dei farmaci e dei prodotti sanitari canadesi | Migliora il coinvolgimento dei pazienti nelle attività regolatorie |
Ruolo dei fornitori di servizi normativi:
In questo panorama in evoluzione, il ruolo dei professionisti e dei partner degli affari regolatori è diventato più cruciale che mai. Essi fungono da ponte tra gli sponsor, le autorità sanitarie e i pazienti, assicurando che le strategie regolatorie siano in linea con gli approcci incentrati sul paziente.
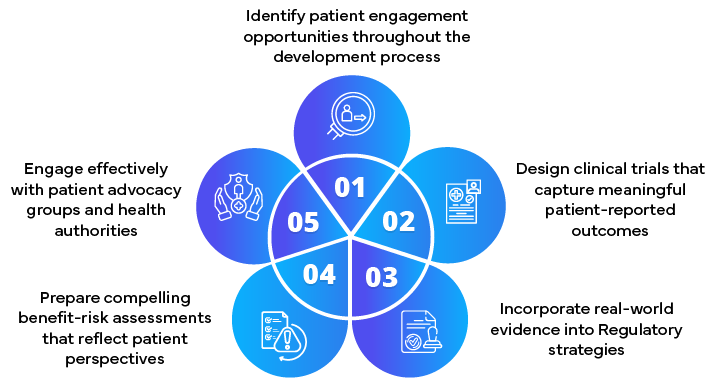
Le responsabilità principali includono:
- Sviluppare strategie di coinvolgimento dei pazienti
- Incorporare il contributo dei pazienti nelle proposte normative
- Consulenza sulla raccolta e la presentazione di dati incentrati sul paziente
- Facilitare l'impegno precoce con le autorità sanitarie
- Mantenere il passo con l'evoluzione dei requisiti normativi incentrati sul paziente
Il ruolo dei partner regolatori nella realizzazione di sottomissioni centrate sul paziente
Sintesi:
Il passaggio alla centralità del paziente negli affari regolatori rappresenta un'opportunità significativa per sviluppare e approvare prodotti medici che rispondano veramente alle esigenze dei pazienti. Abbracciando questo approccio, gli sponsor possono non solo navigare più efficacemente nei percorsi regolatori, ma anche fornire prodotti che fanno una differenza significativa nella vita dei pazienti. Poiché le autorità sanitarie continuano a perfezionare i loro approcci incentrati sul paziente, l'esperienza dei fornitori di servizi regolatori o dei partner diventa preziosa per garantire che le proposte non solo soddisfino i requisiti tecnici, ma siano anche in linea con le esperienze e le priorità dei pazienti.
In questa nuova era affari regolatori, mettere i pazienti al primo posto non è solo una buona pratica, ma è la chiave del successo.









