
I medicinali per terapie avanzate (ATMP) rappresentano un approccio all'avanguardia alla medicina, che sfrutta il potere delle cellule, dei tessuti o dei geni per trattare una varietà di disturbi. A causa della loro complessità e novità, i requisiti normativi per i medicinali per terapie avanzate (ATMP) sono comprensibilmente rigorosi. Ciò si estende anche alla artwork nelle richieste di autorizzazione, che svolge un ruolo cruciale nel trasmettere informazioni critiche in modo chiaro e conciso.
Quando si adattano artwork normative artwork i medicinali per terapie avanzate (ATMP), è necessario tenere conto delle seguenti considerazioni:
Consulta Artwork nostri Artwork in materia di normative Artwork
Richiesta di consulenza
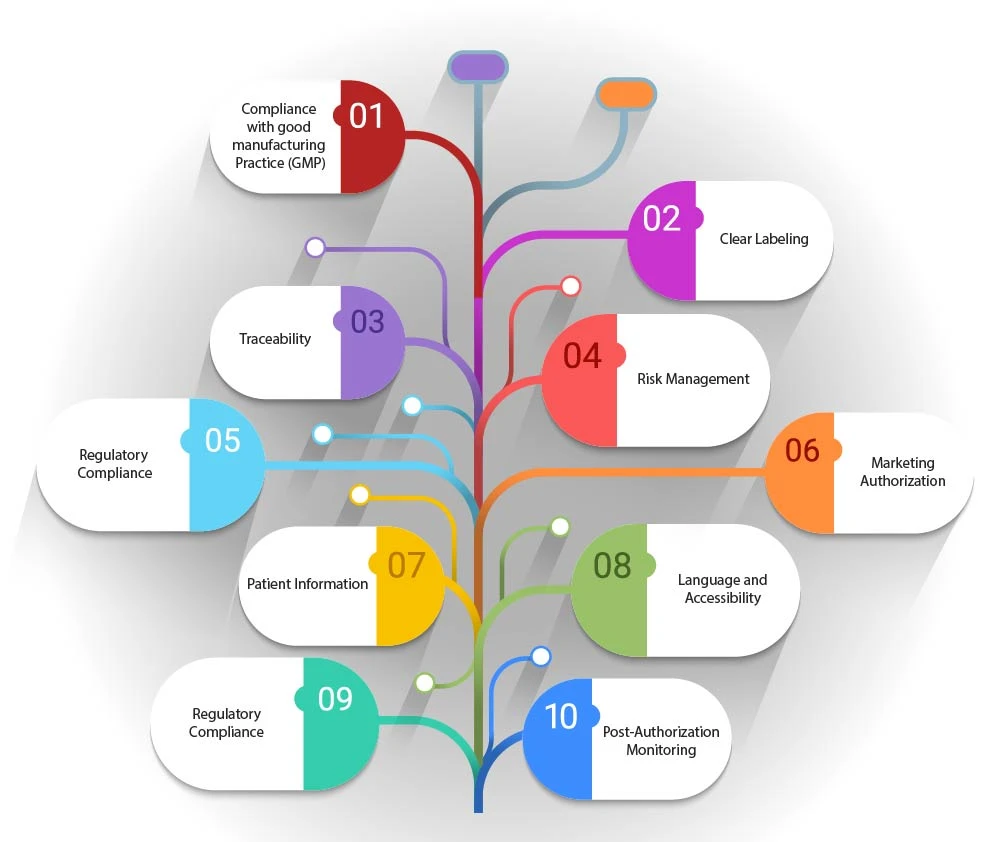
- Conformità alle buone pratiche di fabbricazione (GMP): la artwork essere conforme alle linee guida GMP specifiche per gli ATMP, che possono includere dettagli sul processo di fabbricazione, sul controllo qualità e sulla tracciabilità.
- Etichettatura chiara: la artwork indicare la natura del prodotto, specificando se si tratta di una terapia genica, una terapia cellulare somatica o un prodotto di ingegneria tissutale. Deve inoltre includere eventuali requisiti specifici di conservazione o manipolazione.
- Tracciabilità: data la natura personalizzata di molti medicinali per terapie avanzate (ATMP), la artwork facilitare la tracciabilità. Ciò può comportare l'uso di identificatori univoci o codici a barre che consentono di tracciare il prodotto dalla produzione alla somministrazione al paziente.
- Gestione dei rischi: Artwork includere informazioni relative alla gestione dei rischi, quali potenziali effetti collaterali o controindicazioni, al fine di garantire che i pazienti e gli operatori sanitari siano pienamente informati.
- Conformità normativa: artwork rispettare il quadro normativo stabilito dalla legislazione, come il regolamento (CE) n. 1394/2007, che definisce i requisiti per l'autorizzazione all'immissione in commercio, la supervisione e la farmacovigilanza dei medicinali avanzati di terapia (ATMP).
- Autorizzazione all'immissione in commercio: la artwork riflettere lo stato dell'autorizzazione all'immissione in commercio del prodotto, indicando se è completamente autorizzato, in fase di sperimentazione clinica o soggetto a esenzione ospedaliera.
- Informazioni per il paziente: Artwork includere foglietti illustrativi per il paziente che forniscano informazioni complete sul medicinale terapeutico avanzato (ATMP), sul suo utilizzo e su eventuali controlli necessari dopo la somministrazione.
- Lingua e accessibilità: artwork essere progettata in modo da essere accessibile e comprensibile, tenendo conto della lingua e della leggibilità delle informazioni fornite.
- Informazioni sugli organismi di regolamentazione: artwork includere informazioni sugli organismi di regolamentazione competenti, quali l'Agenzia europea per i medicinali (EMA) e il Comitato per le terapie avanzate (CAT), responsabili della valutazione e dell'approvazione dei medicinali per terapie avanzate (ATMP).
- Monitoraggio post-autorizzazione: se applicabile, il artwork menzionare eventuali monitoraggi post-autorizzazione o studi aggiuntivi necessari per valutare ulteriormente la sicurezza e l'efficacia a lungo termine dell'ATMP.
L'adattamento artwork normativa artwork gli ATMP richiede un approccio meticoloso, che bilancia l'accuratezza scientifica, la chiarezza della comunicazione e il rispetto dei requisiti normativi in continua evoluzione. Sebbene le competenze interne siano preziose, orientarsi in questo panorama complesso può essere estremamente vantaggioso.
È qui che Freyr Solutions in gioco la collaborazione con uno specialista come Freyr Solutions . Freyr offre un team di artwork normativa con una profonda esperienza nel campo degli ATMP. Essi comprendono le sfide specifiche associate alla artwork ATMP artwork possiedono le competenze tecniche necessarie per creare immagini chiare, conformi e di grande impatto.
Nel panorama competitivo odierno, una solida presentazione normativa può fare la differenza tra il successo e il fallimento. Collaborando con Freyr Solutions, potrete garantire che artwork del vostro ATMP metta in risalto artwork il potenziale della vostra terapia, aprendo la strada a un percorso normativo più agevole. Grazie alle sue conoscenze specialistiche e al suo approccio collaborativo, Freyr diventa una risorsa preziosa per portare sul mercato il vostro innovativo ATMP. Contattateci oggi stesso!









