
Nel settore farmaceutico, la sicurezza dei pazienti e la conformità normativa sono fondamentali. Un aspetto critico per garantire entrambe è la valutazione e il controllo delle impurità genotossiche nei prodotti farmaceutici. La linea guida M7 dell'International Council for Harmonization (ICH) fornisce un quadro completo per la gestione di queste impurità, che possono causare mutazioni genetiche e portare al cancro. Le impurità genotossiche, anche in tracce minime, comportano rischi significativi per i pazienti. Queste impurità possono causare mutazioni genetiche, potenzialmente portando al cancro. Pertanto, una corretta identificazione, valutazione dei rischi e controllo delle impurità genotossiche sono essenziali per mitigare tali rischi e garantire la sicurezza e l'efficacia dei prodotti farmaceutici. Questo blog esplora gli aspetti chiave ICH, le sfide che affronta e il ruolo degli esperti normativi nel raggiungimento della conformità.
Aspetti chiave dell'ICH
La linea guida ICH delinea un approccio strutturato alla valutazione e al controllo delle impurità genotossiche. Comprende diversi elementi chiave:
Valutazione del rischio
La valutazione del rischio comporta l'identificazione di potenziali impurezze genotossiche e la valutazione del loro rischio sulla base della loro struttura chimica, dei dati relativi a composti simili e dei dati tossicologici disponibili. Questa fase è fondamentale per determinare quali impurità devono essere controllate e a quali livelli.
Strategie di controllo
Una volta identificate le potenziali impurità genotossiche, è necessario attuare strategie di controllo per limitarne la presenza entro limiti accettabili. Ciò include lo sviluppo e la convalida di metodi analitici per rilevare le impurità e l'implementazione di controlli di produzione per ridurre al minimo la loro formazione.
Presentazione normativa
La documentazione completa e la giustificazione delle valutazioni del rischio e delle strategie di controllo sono richieste per la presentazione alle autorità regolatorie. In questo modo si garantisce che gli enti regolatori dispongano di tutte le informazioni necessarie per valutare la sicurezza del prodotto farmaceutico.
Tabella 1: Componenti dell ICH
| Componente ICH | Descrizione |
|---|---|
| Valutazione dei pericoli | Identifica e classifica le impurità in base al loro potenziale genotossico. |
| Caratterizzazione del rischio | Valuta i livelli di esposizione e i rischi potenziali per i pazienti |
| Misure di controllo | Strategie per limitare o eliminare le impurità durante la produzione |
(Non limitato a)
Il ruolo degli esperti normativi
Navigare tra i complessi requisiti ICH può essere difficile per le aziende farmaceutiche. È qui che gli esperti in materia di regolamentazione svolgono un ruolo fondamentale, fornendo una guida esperta sulla valutazione dei rischi, sulle strategie di controllo e sulla preparazione di documenti normativi completi. Sfruttando la loro competenza, le aziende possono garantire la conformità ICH e mitigare i potenziali rischi associati alle impurità genotossiche.
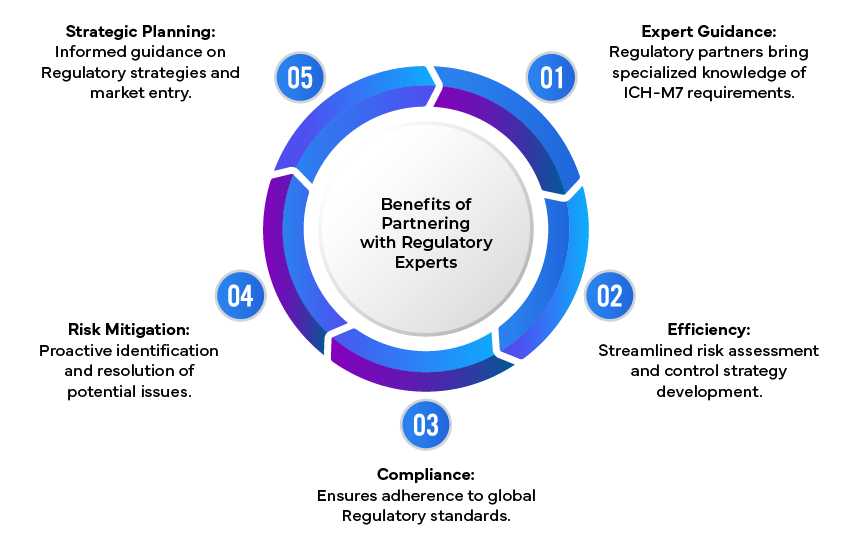
Sintesi
La conformità alle linee guida ICH è essenziale per garantire la sicurezza e l'efficacia dei prodotti farmaceutici. Adottando un approccio strutturato alla valutazione e al controllo delle impurità genotossiche, le aziende possono proteggere la sicurezza dei pazienti e soddisfare i requisiti normativi. La collaborazione con esperti in materia di regolamentazione semplifica ulteriormente questo processo, fornendo le competenze necessarie per orientarsi in contesti normativi complessi e ottenere il successo delle richieste di autorizzazione.









