
A partire dal 31 gennaio 2022, il nuovo regolamento farmaceutico dell'Unione Europea (UE) sulla sperimentazione clinica (CTR) è diventato obbligatorio, abrogando la Direttiva sulla sperimentazione clinica 2001/20/CE. Il regolamento armonizza i protocolli di valutazione e supervisione delle sperimentazioni cliniche in tutta l'UE. Le linee guida sono state riviste per promuovere un approccio uniforme alla ricerca clinica, sottolineando al contempo la sicurezza dei partecipanti alle sperimentazioni cliniche e una maggiore divulgazione al pubblico.
Il regolamento stabilisce un nuovo sistema di valutazione in due parti per tutte le sperimentazioni cliniche dell'UE. La prima parte consiste in una valutazione scientifica dei documenti fondamentali della sperimentazione clinica, mentre la seconda consiste in una valutazione etica della documentazione a livello nazionale. A seguito di questa valutazione in due parti, ogni Stato membro prenderà una decisione unificata sulla sperimentazione e la comunicherà allo sponsor attraverso il Sistema informativo sulle sperimentazioni cliniche.
Tempi di transizione per i nuovi richiedenti
Una fase di transizione di tre anni è iniziata con la data di attivazione del CTIS dell'UE.
Anno 1 (dal 31 gennaio 2022 al 30 gennaio 2023):
La direttiva 2001/20/CE dell'Unione europea (UE) relativa alle sperimentazioni cliniche (EU-CTD) disciplina le sperimentazioni cliniche nell'UE dal 2004. Essa mirava a standardizzare le norme e ha migliorato in modo significativo la sicurezza dei pazienti nelle sperimentazioni cliniche. Tuttavia, nella pratica, ha creato conseguenze indesiderate. Durante il primo anno, a seguito CTIS , gli sponsor potevano scegliere se presentare una nuova domanda di sperimentazione clinica (CTA) nell'ambito del sistema di informazione sulle sperimentazioni cliniche (CTIS) ai sensi della direttiva sulle sperimentazioni cliniche (CTD: direttiva 2001/20/CE) o utilizzare CTIS conformità con la legislazione vigente, il regolamento (UE) n. 536/2014 sulle sperimentazioni cliniche.
Entrambe le idee erano valide e gli sponsor hanno avuto la possibilità di scegliere quale legislazione portare avanti.
I membri erano pronti a utilizzare il sistema informativo sulle sperimentazioni cliniche (CTIS) e hanno accettato le domande presentate ai sensi della nuova normativa, il regolamento sulle sperimentazioni cliniche (EU CTR), il primo giorno di CTIS .
Anni 2 e 3 (dal 31 gennaio 2023 al 31 gennaio 2025):
A partire dal 31 gennaio 2023, tutte le nuove domande CT devono essere presentate tramite il CTIS ai sensi della nuova legislazione (CTR).
Le nuove domande CT non possono essere presentate in EudraCT ai sensi della direttiva sulle sperimentazioni cliniche (CTD). La direttiva UE sulle sperimentazioni cliniche non consente più l'ammissione di nuovi Member States il 31 gennaio 2023. Le sperimentazioni condotte ai sensi della CTD devono prima essere trasferite, dopodiché è possibile presentare una domanda aggiuntiva relativa agli Stati membri tramite CTISEU CTIS.
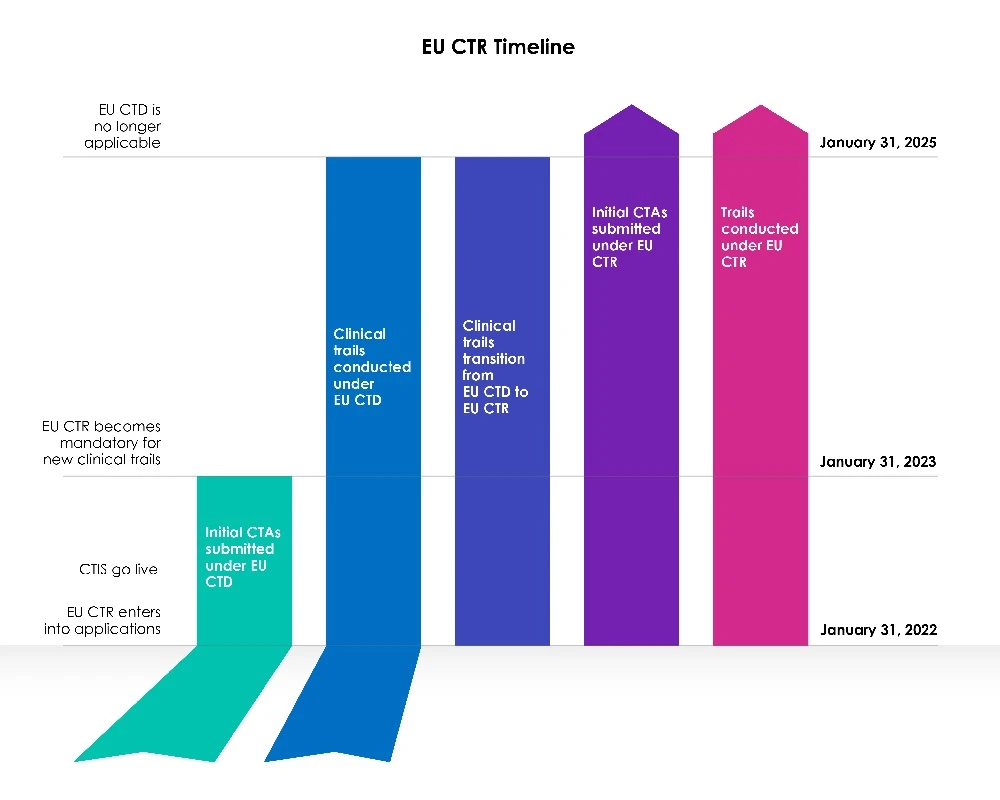
Per i richiedenti esistenti
Le domande di CT presentate prima del 30 gennaio 2023, in base alla vecchia legislazione (CTD), utilizzando EudraCT, saranno consentite fino al completamento in base a tale direttiva (CTD: direttiva 2001/20/CE), fino al 30 gennaio 2025. Le procedure rimarranno invariate e gli sponsor potranno presentare modifiche significative e avvisi di fine sperimentazione come previsto dalla normativa. EudraCT rimarrà attivo durante il periodo di transizione per consentire la prosecuzione di queste sperimentazioni.
È tuttavia importante notare che le domande di transizione possono essere presentate in qualsiasi momento durante il periodo di transizione di tre (03) anni, e gli sponsor sono incoraggiati a completare il processo abbastanza presto nel periodo di transizione per garantire la continuità della sperimentazione clinica nell'UE oltre il 30 gennaio 2025, considerando le festività legali e lo stop invernale di due (02) settimane.
Prove non trasferibili
- I procedimenti giudiziari che si sono conclusi o che si concluderanno poco prima della fine del periodoEEA non devono essere oggetto di transizione.
- Se la notifica di fine sperimentazione è stata completata in tutti i paesiEEA , ma la fine globale della sperimentazione non è stata ancora notificata, lo studio non deve essere trasferito. Ai sensi della direttiva, la fine globale della sperimentazione e i risultati sintetici della sperimentazione devono essere pubblicati tramite EudraCT.
- Le sperimentazioni iniziate prima dell'attuazione della Direttiva 2001/20/CE non beneficiano di tale procedura di transizione. Se sono di tipo interventistico e devono continuare a operare dopo la fine della fase di transizione della CTR, è necessario emettere una nuova richiesta di CT nell'ambito della CTR.
- Anche gli studi pediatrici condotti al di fuori dellEEA ai quali è stato assegnato un numero EudraCT non devono essere convertiti.
- Le sperimentazioni sospese dopo la fine del periodo di transizione non possono essere oggetto di transizione. Il riavvio della sperimentazione in queste circostanze richiederebbe la presentazione da parte della CT Application di una nuova domanda ai sensi della CTR.
CTIS dell'UE CTIS EMA aggiornamenti tecnici EMA per migliorare le sue caratteristiche e funzionalità. Quando vengono apportate modifiche importanti al CTIS, EMA delle note di rilascio che descrivono le modifiche apportate al sistema. Gli aggiornamenti possono includere miglioramenti alle caratteristiche e funzionalità esistenti, l'aggiunta di nuove caratteristiche e miglioramenti funzionali e tecnici. Un partner esperto in materia di regolamentazione può affrontare le potenziali sfide e aiutare gli sponsor nella transizione delle sperimentazioni cliniche esistenti e future nell'ambito delle strategie di sviluppo clinico. Clicca qui per saperne di più sul CTIS sull'esperienza Freyrin questo settore: https://regulatoryaffairs.freyrsolutions.com/clinical-trial-applications-ctas.









