
La Food and Drug Administration (FDAUS ha pubblicato nel dicembre 2022 una linea guida che costituisce una revisione della linea guida intitolata "Mancata risposta a una lettera di risposta ANDA (CRL) ANDA entro i termini previsti dalla normativa - Linee guida per l'industria" del luglio 2022. Lo scopo è quello di fornire una guida ai richiedenti di domande abbreviate di autorizzazione all'immissione in commercio di nuovi farmaci (ANDA) presentate ai sensi della sezione 505(j) del Federal Food, Drug, and Cosmetic Act (FD&C Act) (21 U.S.C. 355(j)). Una risposta completa e pertinente a una CRL è fondamentale per l'approvazione del farmaco generico. Il documento di orientamento offre raccomandazioni sulle ripercussioni della ricezione di una CRL e sulle azioni FDA intraprendere se la CRL non riceve risposta entro i termini specificati.
La FDA garantire che i farmaci generici approvati soddisfino gli standard di sicurezza, qualità, efficacia e accessibilità economica. Se ANDA soddisfa i requisiti FDA , al richiedente viene inviata una CRL che include le carenze individuate durante la valutazione.
Di seguito è riportata una descrizione figurativa di ciò che un richiedente può fare entro un anno dal ricevimento del CRL:
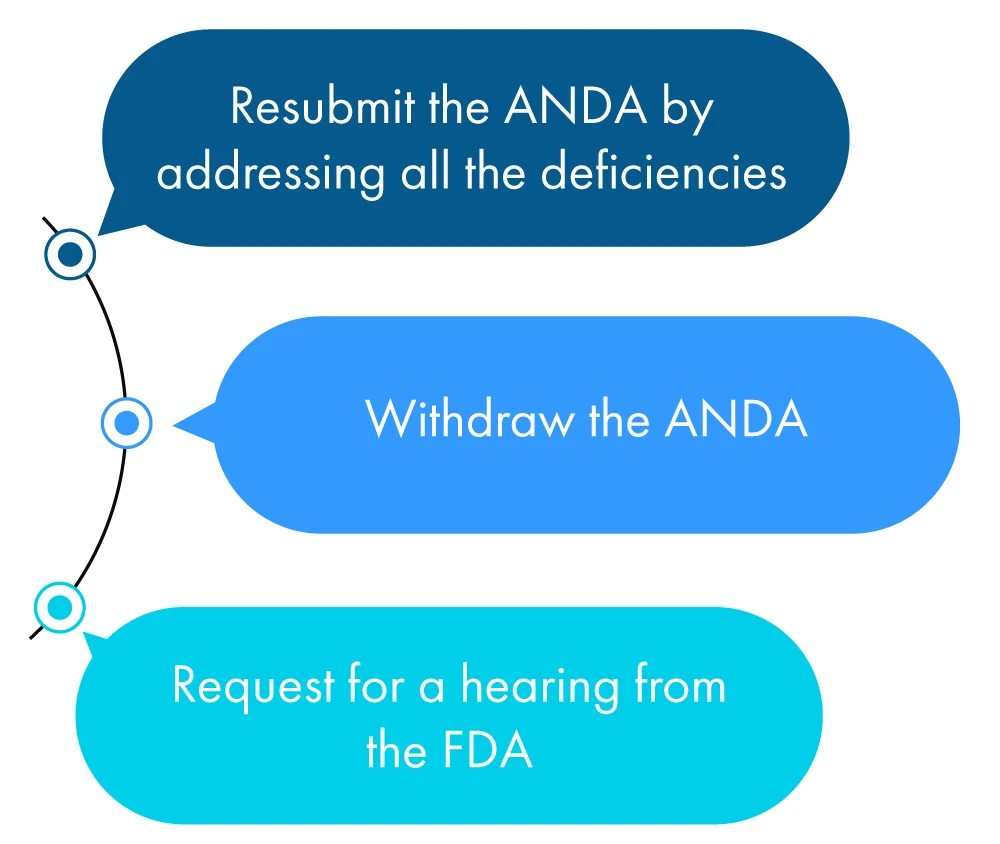
Se il richiedente non intraprende nessuna delle azioni sopra indicate, la FDA tale comportamento come una richiesta di ritiro ANDA il richiedente non abbia richiesto una proroga per verificare tutte le discrepanze menzionate nella CRL.
Cosa succede dopo un (01) anno dall'emissione della CRL?
La FDA una notifica scritta in cui comunica al richiedente che ha trenta (30) giorni di tempo dalla notifica per:
- Motivare perché ANDA non ANDA essere ritirata.
- Richiesta di una proroga per risolvere tutte le carenze menzionate nella CRL.
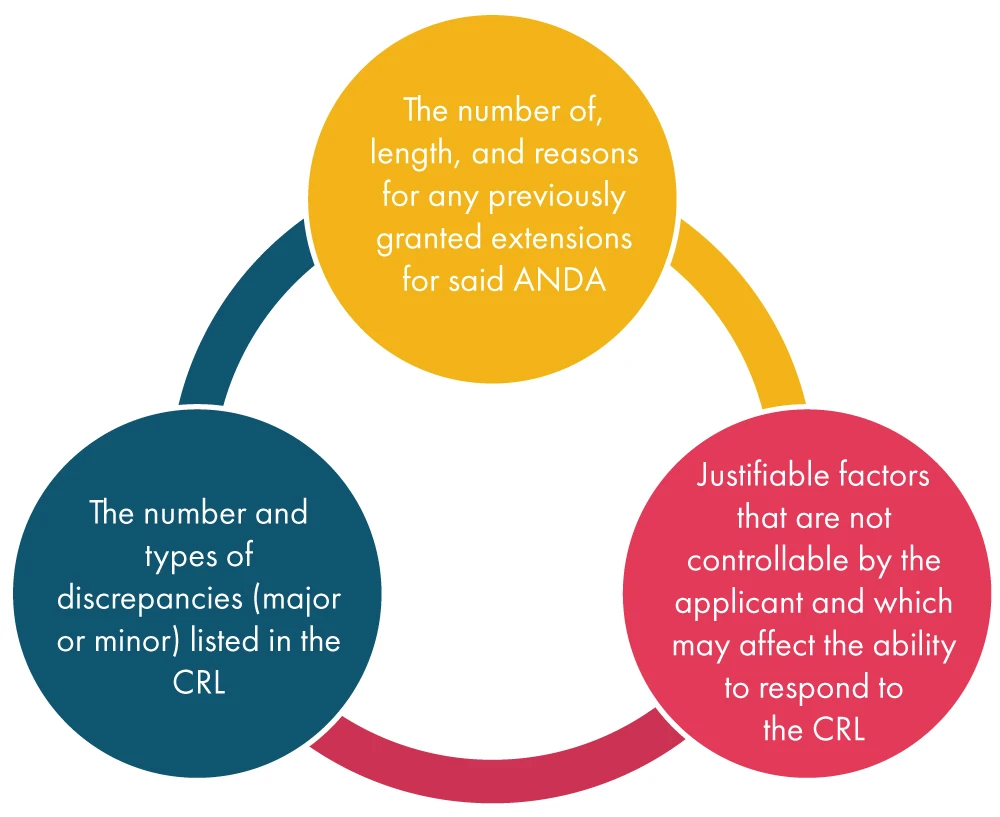
Una volta FDA dal richiedente la richiesta di proroga, la FDA valuta i vari fattori indicati di seguito e decide in merito alla richiesta:
Che cos'è un emendamento?
Il richiedente deve presentare una richiesta di proroga per rispondere a una CRL tramite una modifica. La FDA una modifica come maggiore o minore in base all'effetto che ha sul processo di approvazione.
FDA fondamentali FDA che i richiedenti devono conoscere:
- La FDA una modifica minore come modifica maggiore se la modifica viene presentata dopo un anno dalla CRL, a meno che ANDA un prodotto presente nell'elenco dei farmaci in carenza ai sensi della sezione 506E del FD&C Act (21 U.S.C. 356e), o è oggetto di una risposta a un'emergenza sanitaria pubblica dichiarata dal Segretario del US della Salute e dei Servizi Umani US ai sensi della sezione 319 del Public Health Service Act (42 U.S.C. 247d), o si prevede che sarà soggetto agli stessi criteri applicabili a tale dichiarazione, al momento della presentazione.
- Se il richiedente non risolve le discrepanze indicate nella CRL entro il periodo di proroga concesso dalla FDA, quest'ultima può prendere in considerazione la revoca ANDA.
- Se il richiedente necessita di un periodo di proroga superiore ai trenta (30) giorni, può richiedere un'ulteriore proroga. La modifica dovrà quindi includere nuove informazioni che consentano alla FDA determinare se la proroga possa essere concessa o meno.
Ottenere una CRL dalla FDA può essere piuttosto scoraggiante per i richiedenti ANDA. Dalla risoluzione delle discrepanze alla citazione delle ragioni/informazioni corrette per una proroga, tutti i requisiti pertinenti devono essere soddisfatti per garantire un'approvazione più rapida del farmaco. Freyr è un esperto normativo comprovato con una vasta conoscenza nella risposta alle CRL e nella garanzia di conformità ai requisiti FDA. Contattaci ora per un supporto strategico End-to-End nelle presentazioni ANDA.









