I radiofarmaci sono farmaci che contengono radioisotopi, utilizzati come agenti diagnostici e terapeutici. Mirano a organi, tessuti o cellule specifici nel corpo umano. Questi prodotti medicinali possono essere somministrati per via orale, endovenosa o interstiziale e costituiscono una sottospecialità della radioterapia. Esistono normative severe per la commercializzazione dei radiofarmaci, poiché possono essere somministrati solo da un professionista specializzato in medicina nucleare. Tuttavia, le opportunità sono immense grazie alla loro capacità di diagnosticare alcuni problemi medici o trattare malattie come il cancro. Il mercato globale dei radiofarmaci ha raggiunto circa 5,9 miliardi di dollari USA entro il 2022 e si prevede che raggiungerà 11,93 miliardi di dollari USA entro il 2030, crescendo a un tasso di crescita annuale composto (CAGR) dell'11,76%.
Le aziende farmaceutiche di tutto il mondo stanno cercando di conquistare la loro quota di mercato dei radiofarmaci, incluse quelle in Canada. Health Canada (HC), l'Autorità Sanitaria Canadese (HA), è nota per i suoi sforzi nel rendere disponibili servizi sanitari di alta qualità al pubblico. Sono in vigore linee guida/regolamenti rigorosi per garantire innanzitutto la sicurezza del paziente. I produttori/sponsor che desiderano entrare nel mercato canadese dei radiofarmaci devono comprendere i regolamenti stabiliti da HC e, di conseguenza, progettare la strategia di presentazione ideale per ottenere un'approvazione più rapida sul mercato.
La roadmap regolatoria per la presentazione di radiofarmaci in Canada
Tutti i farmaci commercializzati in Canada devono rispettare il Food and Drugs Act (FDA) e il Food and Drugs Regulations (FDR). I radiofarmaci sono elencati nell'Allegato C della FDA. La Direzione dei Prodotti Biologici e delle Terapie Genetiche (BGTD), HC, regola l'autorizzazione all'immissione in commercio di questi prodotti. Sono approvati per l'uso umano in base alla valutazione soddisfacente della sicurezza, efficacia e qualità delle richieste di radiofarmaci.
HC è membro ufficiale dell'International Council for Harmonization of Technical Requirements for Pharmaceuticals for Human Use (ICH). Ha adottato i ICH relativi a qualità, sicurezza, efficacia e argomenti multidisciplinari. L'elenco di tali documenti è disponibile sul sito web di HC per riferimento degli sponsor.
Oltre ai documenti sopra citati, la Guida per l'industria: Gestione delle richieste di autorizzazione all'immissione in commercio dei farmaci (documento di orientamento), aggiornata l'ultima volta il 2 agosto 2022, us sul punto di vista dell'HC nella valutazione delle informazioni presentate dagli sponsor sui radiofarmaci. Il grafico sottostante (Figura 1) offre una panoramica degli argomenti trattati nel documento di orientamento.
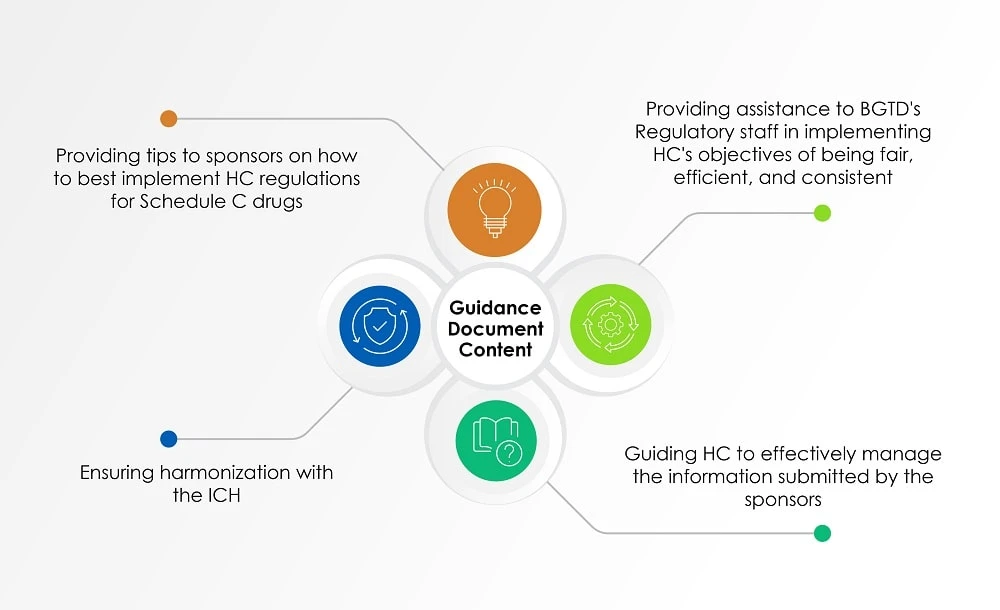
Figura 1: Contenuto di un documento di orientamento
I requisiti normativi per i farmaci della Tabella C sono gli stessi degli altri farmaci. I requisiti comprendono la presentazione di domande e l'iter per ottenere l'autorizzazione all'immissione in commercio. Tuttavia, i requisiti per la presentazione dei dati sono diversi da quelli degli altri farmaci a causa delle loro proprietà specifiche.
NDS
Il produttore/sponsor del farmaco deve presentare una New Drug Submission (NDS) al BGTD, che deve contenere i seguenti dati:
- Informazioni sulla sicurezza, la qualità e l'efficacia del farmaco.
- Rapporti/risultati di studi preclinici e clinici.
- Informazioni sulla produzione del farmaco.
- Etichettatura e dettagli dell'imballaggio.
- Indicazioni terapeutiche e potenziali effetti collaterali del farmaco.
Lo sponsor può fare una presentazione al BGTD prima di presentare la NDS. Questo incontro preliminare alla presentazione è vantaggioso, in quanto lo sponsor può affrontare eventuali lacune/richieste sollevate dal BGTD e assicurarsi che la presentazione contenga tutte le informazioni richieste. L'incontro dovrebbe svolgersi idealmente tre (03) mesi prima della data di scadenza della presentazione.
Gli sponsor possono anche prendere in considerazione percorsi di revisione alternativi, come la Priority Review o la Notice of Compliance with Conditions (NOC/c). Ecco una sintesi di ciascuno dei due percorsi:
- Revisione prioritaria: Questo percorso si applica a una NDS o a un Supplemento alla presentazione di un nuovo farmaco (SNDS) per una malattia/condizione potenzialmente letale o gravemente invalidante per la quale esistono prove sufficienti dell'efficacia del farmaco in termini di diagnosi, trattamento o prevenzione di tale condizione. Si applica anche quando vi è un sostanziale aumento dell'efficacia e/o una notevole riduzione del rischio per una malattia che non ha un farmaco efficace sul mercato canadese.
- NOC/c: Questo percorso considera la valutazione del rapporto rischio/beneficio di un farmaco. Il NOC/c è per un farmaco che ha un profilo di sicurezza accettabile per una malattia/condizione pericolosa per la vita o gravemente invalidante. L'autorizzazione viene concessa con prove favorevoli per il farmaco radiofarmaceutico. Questo percorso si applica a NDS, SNDS e Abbreviated New Drug Submission (ANDS).
Il formato NDS
HC ha adottato il formato elettronico Common Technical Document (eCTD) per la presentazione di farmaci radiofarmaceutici. Infatti, sono stati creati modelli separati di Quality Information Summary, come QIS-R e QIS-PER, per la presentazione di radiofarmaci.
Conclusione
Mentre HC regolamenta l'autorizzazione al mercato dei radiofarmaci sulla base di una valutazione soddisfacente della sicurezza, dell'efficacia e della qualità dei prodotti presentati, la Canadian Nuclear Safety Commission (CNSC) regolamenta la sicurezza dalle radiazioni dei farmaci radiofarmaceutici. La CNSC controlla aspetti quali la manipolazione, l'imballaggio, l'etichettatura, lo stoccaggio, lo smaltimento, ecc. dei materiali radioattivi. Inoltre, stabilisce le norme per le attrezzature utilizzate per la produzione di farmaci radiofarmaceutici.
La conformità alle normative vigenti dell'HC e della CNSC è essenziale per una valutazione soddisfacente delle richieste di autorizzazione dei farmaci radioattivi. Collaborate con un esperto in materia di normative come Freyr attività di pubblicazione e presentazione senza errori e senza intoppi in Canada. Rimanete informati! Rimanete conformi!









