
La pubblicità farmaceutica, inclusa la pubblicità diretta al consumatore, è regolamentata dalla Food and Drug Administration degli Stati Uniti (US FDA), dall'Ufficio per la Promozione dei Farmaci da Prescrizione (OPDP), dal Ramo per la Pubblicità e l'Etichettatura Promozionale (APLB) presso il Centro per la Valutazione e la Ricerca sui Farmaci (CDER) e dal Centro per la Valutazione e la Ricerca sui Prodotti Biologici (CBER) rispettivamente. Le informazioni presentate all'OPDP e all'APLB devono essere accurate, etiche e non fuorvianti. Ulteriori informazioni sui benefici e sui rischi del prodotto devono essere incluse nella presentazione. Gli Uffici esaminano anche i materiali promozionali presentati all'Agenzia.
Nell'aprile 2022, la US FDA ha pubblicato linee guida sulle presentazioni per il materiale promozionale di etichettatura e pubblicità. Le linee guida aiutano a comprendere la presentazione elettronica nel Modulo 1 dell'eCTD, utilizzando la versione 3.3 o superiore del file backbone regionale US. Nel documento è elencata una menzione dei tipi di materiali promozionali non soggetti alla presentazione elettronica obbligatoria ai sensi della sezione 745A. Le copie cartacee di tutti i tipi di presentazione promozionale saranno accettate fino a ventiquattro mesi dopo la pubblicazione delle linee guida.
Eccezione
Il documento stabilisce che le richieste presentate ai sensi della sezione 505(b), (i) o (j) del Federal Food, Drug, and Cosmetic Act (FD&C Act) e le richieste presentate ai sensi della sezione 47 351(a) o (k) del Public Health Service (PHS) Act devono essere presentate in formato elettronico come definito dalla FDA. Il presente documento non è soggetto alle consuete restrizioni previste dalle norme di buona pratica FDAin materia di orientamenti, in quanto non è stato stabilito legalmente per responsabilità esecutive. Pertanto, la parte del presente orientamento che stabilisce il requisito delle presentazioni elettroniche ai sensi della sezione 745A(a) del FD&C Act ha effetto vincolante, come indicato dall'uso dei termini "deve", "dovrà" o "richiesto".
La FDA il materiale promozionale redatto entro quarantacinque (45) giorni dalla presentazione volontaria da parte degli sponsor. Per qualsiasi domanda relativa al prodotto sollevata da operatori sanitari, consumatori, sponsor di farmaci o studi legali, l'OPDP concede agli sponsor il tempo di trenta (30) giorni di calendario per rispondere.
Definizione di materiale promozionale
Il termine "materiale promozionale" si riferisce all'etichettatura promozionale e al materiale pubblicitario, indipendentemente dal formato, dalle modalità o dal mezzo attraverso cui vengono comunicati. La FDA supervisiona FDA due (02) tipi di etichettatura per i farmaci:
- Etichettatura FDA
- Etichettatura promozionale
Secondo la sezione 201(m) della FDA, l'etichettatura è definita come "tutte le etichette oltre a quelle scritte, stampate o grafiche in rilievo su qualsiasi contenitore, involucro, o su qualsiasi articolo o che accompagnano tale articolo". Il linguaggio utilizzato in "che accompagnano tale articolo" è considerato un'interpretazione o una spiegazione del materiale promozionale, come dichiarato dalla Corte Suprema degli US.
Criteri per l'invio di materiale promozionale da sottoporre a revisione
- Inclusione dei BLA NDA, ANDA o BLA appropriati
- Nei casi in cui i richiedenti necessitino di una revisione immediata, indirizzare le richieste al Project Manager dell'OPDP.
- Dal modulo FDA , assegnare il tipo di materiale più specifico per rappresentare il materiale promozionale.
- I diversi tipi di materiali devono essere presentati separatamente
- Non mischiare altri invii con materiale promozionale.
- Il materiale promozionale destinato agli operatori sanitari deve essere presentato separatamente da quello destinato ai consumatori.
Le metriche di seguito riportate chiariscono il conteggio dei moduli 2253 inviati e i materiali inclusi in tali invii.
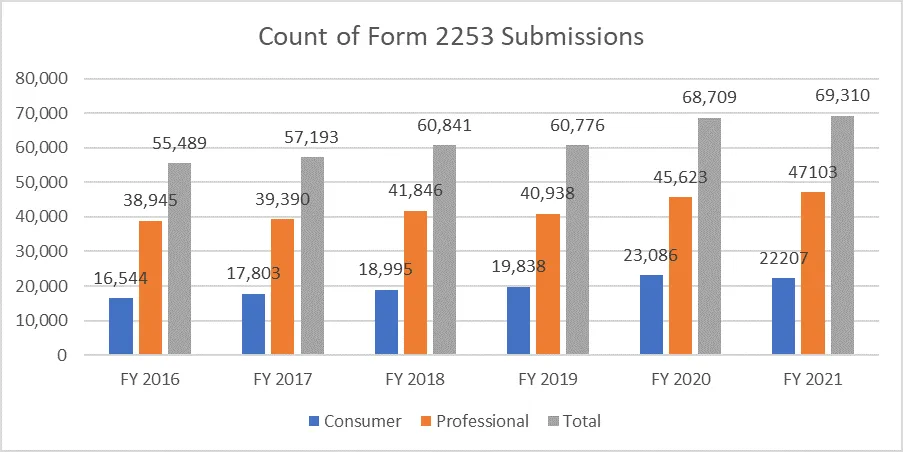
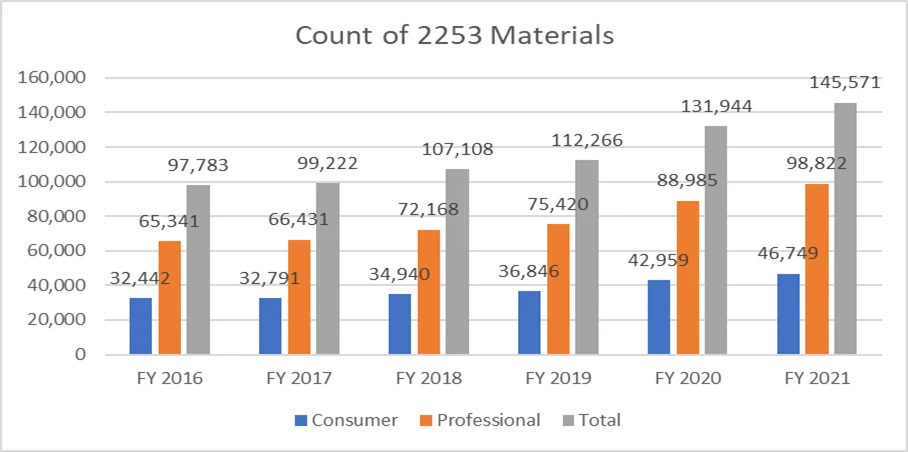
È di fondamentale importanza che gli sponsor redigano il proprio materiale promozionale secondo le linee guida fornite dalla FDA evitare cicli di revisione multipli, dato il costo del processo. Disporre di risorse in grado di facilitare il processo di presentazione del materiale promozionale senza intoppi può consentire agli sponsor di raggiungere i propri obiettivi aziendali e rimanere al passo con i requisiti normativi. Un partner normativo collaudato come Freyr garantire una revisione completa del materiale promozionale e non promozionale prima della presentazione, sia in formato elettronico che non elettronico. Contattate Freyr oggi stesso per redigere materiale promozionale chiaro, conciso e conforme sin dal primo tentativo.









