
La maggior parte delle organizzazioni che operano nel settore delle scienze della vita ha difficoltà a semplificare il processo di presentazione delle domande di autorizzazione a causa dei frequenti cambiamenti nelle linee guida per la presentazione. Secondo una recente analisi condotta dalla Food and Drug Administration (USFDA) degli Stati Uniti, il 32% delle domande presentate con dati di studio presentava problemi critici di conformità dei dati. Il processo richiede una comprensione approfondita della collaborazione tra le parti interessate interne ed esterne. All'interno dell'organizzazione, i reparti di produzione, ricerca e sviluppo, ricerca clinica/non clinica, QA, marketing e vendite devono lavorare in armonia per accelerare il processo di approvazione dallo sviluppo iniziale fino all'immissione del farmaco sul mercato. Il reparto Affari regolatori e le autorità sanitarie (HA) sono in costante contatto per garantire e valutare la sicurezza e l'efficacia dei farmaci per uso umano. us quali misure preliminari devono adottare le organizzazioni farmaceutiche per raggiungere l'eccellenza nelle presentazioni normative:
Allocare e distribuire le risorse per snellire, standardizzare e velocizzare il lavoro di presentazione disorganizzato.
Uno specialista di presentazione partecipa su base contrattuale e può comprendere più di un (01) tipo di presentazione, oltre a essere stato associato a programmi di sviluppo nel corso degli anni, assistendo nella creazione di narrazioni convincenti per il dossier. In questo modo, per le organizzazioni è più facile:
- Eliminare gli errori bilanciando la collaborazione degli stakeholder interni ed esterni.
- Ridurre il ciclo di revisione HA del processo di creazione e approvazione dei documenti.
- Stabilire documenti completi e conformi per tenere il passo con i mutevoli requisiti normativi dei diversi mercati.
- Riconoscere gli invii interessati da un'Autorità di regolamentazione
- Essere al corrente dello stato di creazione, revisione e approvazione delle submission.
- Miglioramento dell'attuale protocollo di presentazione
Semplificare la metodologia di presentazione dei dossier
La stesura di un dossier è fondamentale quando si tratta di preparare le domande di autorizzazione. Si osserva che le domande di licenza biologica (BLA) e le domande di autorizzazione per nuovi farmaci (NDA) sono composte da tonnellate di pagine, il che rende difficile per le autorità di regolamentazione comprendere la narrazione del dossier. Avere una rappresentazione strutturata di un'idea generale può amplificare la capacità del team di preparare le proposte e delle agenzie che le esaminano.
L'utilizzo di moduli per snellire la presentazione delle domande consente agli esperti di analizzare ciò che deve essere incluso in ogni sezione o modulo del dossier. Questa pratica facilita:
- Avvio precoce dell'attività di authoring accelerando la preparazione delle submission da parte dell'organizzazione.
- Utilizzo dei dati rilevanti necessari per l'elaborazione delle proposte
- Utilizzo di risorse adeguate senza la necessità di scrivere da zero documenti esaurienti per ogni invio.
Collaborazione con le autorità di regolamentazione
Ogni organizzazione deve condurre incontri regolari con gli HA come prassi durante la fase iniziale dello sviluppo del prodotto. Ciò garantisce una revisione e un feedback tempestivi, con conseguente accelerazione della risoluzione dei commenti da parte dell'HA e, di conseguenza, del processo di approvazione. Questo non solo crea un buon rapporto tra le organizzazioni e gli HA, ma aiuta anche a fare chiarezza nelle prime fasi della pianificazione della presentazione.
Razionalizzare i contenuti e i dati nel sistema di gestione dei documenti (DMS)
Un solido archivio di contenuti è previsto per gestire tutti i dati tra le diverse aree funzionali, inclusa la documentazione e le informazioni create in precedenza. Un archivio di contenuti e dati strutturati fornisce un accesso senza interruzioni ai documenti da varie aree funzionali senza alcuno sforzo aggiuntivo o la necessità di duplicare. I documenti archiviati nel DMS diventano l'unica fonte di riferimento per tutti gli stakeholder interni (scienze cliniche, CMC, non cliniche, farmacocinetica, farmacodinamica, scrittura medica e operazioni cliniche). Tali contenuti e dati possono essere utilizzati per creare contenuti locali basati sui requisiti regionali. Ottimizzazione delle Presentazioni Normative tramite la Gestione Strutturata di Contenuti e Dati
Adottare la tecnologia e l'automazione per ridurre il lavoro ripetitivo e gli errori.
Le organizzazioni possono sfruttare la tecnologia utilizzando l'aggiornamento automatico e il controllo di qualità delle Tabelle, Elenchi e Figure (TLF) nel testo rispetto ai dati di origine per accelerare il processo di documentazione. In questo modo, ogni volta che vengono apportate modifiche alle tabelle di origine esistenti, il TLF viene aggiornato di conseguenza. Ciò contribuisce a eliminare le ore di lavoro complessive, a risparmiare tempo sul percorso critico e a migliorare l'accuratezza dei dati.
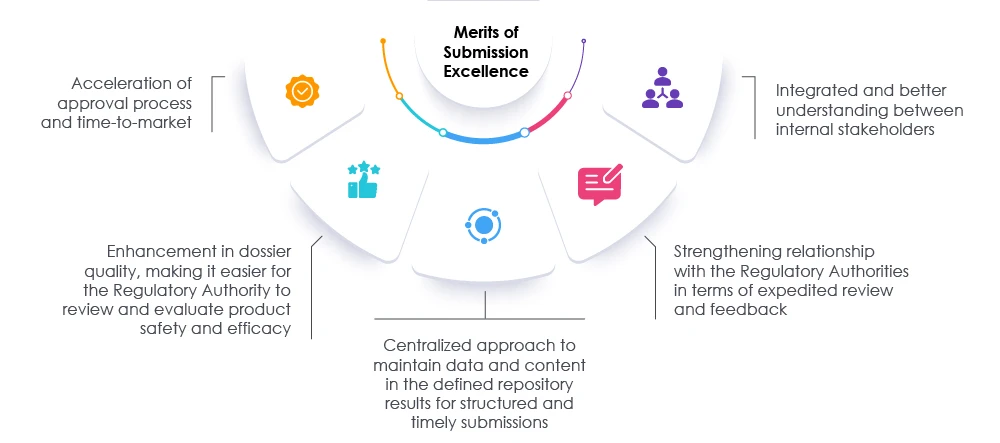
L'adozione di misure appropriate, insieme a revisioni tempestive dei dossier e dei dati, può aiutare sia le autorità di regolamentazione che le organizzazioni ad accelerare il processo di presentazione. Questo approccio riduce il tempo di immissione sul mercato per soddisfare le esigenze sia dei pazienti che del settore. Un partner normativo collaudato può assistere le organizzazioni nel ripensare, rivalutare e modificare gli approcci attuali per la preparazione delle presentazioni. I nostri esperti di Freyr possono facilitare un percorso verso l'eccellenza nelle presentazioni normative aumentando la visibilità all'interno dell'organizzazione e promuovendo la conformità generale, consentendo all'organizzazione di avere successo nel mercato odierno delle scienze della vita. Consultare Freyr.









