
Immaginate di lavorare a un nuovo farmaco per curare una malattia devastante. Dopo anni di duro lavoro, avete finalmente raccolto i dati necessari per presentare una domanda di autorizzazione alla FDA. Ma poi vi rendete conto che i vostri registri elettronici e le vostre firme elettroniche non sono conformi alla norma 21 CFR Part 11. Questo è uno scenario in cui nessuno vorrebbe trovarsi. Il mondo della conformità normativa è complesso e in continua evoluzione. Con l'introduzione continua di nuove normative, può essere difficile per le aziende stare al passo. Tuttavia, esiste una normativa essenziale per qualsiasi azienda che opera in un settore regolamentato: la norma 21 CFR Part 11.
21 CFR Part 11 è un regolamento che stabilisce i criteri per i registri elettronici e le firme elettroniche nelle industrie regolamentate dalla FDA. È progettato per garantire che i registri elettronici siano affidabili, attendibili ed equivalenti ai registri cartacei e alle firme autografe. 21 CFR Part 11 è rilevante per le presentazioni normative perché fornisce indicazioni su come garantire che i registri elettronici e le firme elettroniche siano conformi ai requisiti della FDA. È importante perché le presentazioni normative spesso contengono una quantità significativa di dati elettronici, come dati di studi clinici, registri di produzione e dati di controllo qualità.
Ecco alcuni dei principali vantaggi derivanti dalla conformità alla norma 21 CFR Part 11 le richieste di autorizzazione:
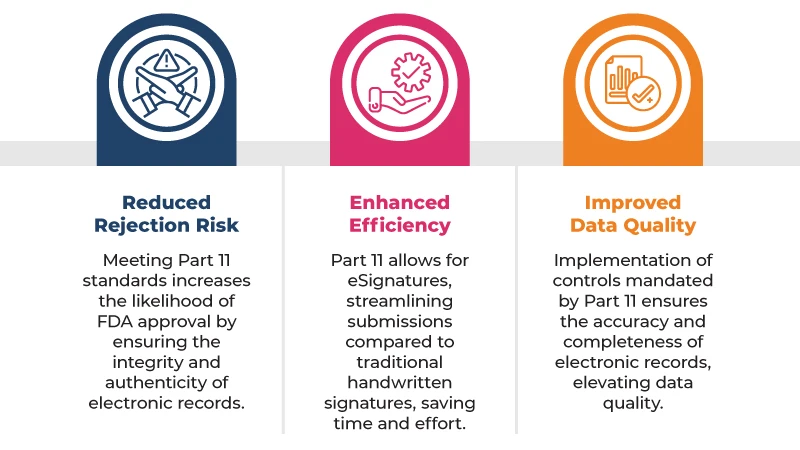
Per conformarsi alla norma 21 CFR Part 11, le aziende devono implementare una serie di controlli, tra cui:
- Convalida dei sistemi: Assicurarsi che i sistemi elettronici soddisfino i requisiti della Parte 11, tra cui una solida sicurezza, tracce di audit e test di integrità dei dati.
- Controllo dell'accesso degli utenti: Limitare l'accesso al personale autorizzato mediante protezione con password, firme elettroniche e altri metodi di autenticazione.
- Mantenere le tracce di controllo: Implementare gli audit trail per tenere traccia di tutte le modifiche ai record, consentendo di individuare e indagare sulle alterazioni non autorizzate.
- Garantire la sicurezza dei dati: Impiegare misure di sicurezza dei dati per salvaguardare le registrazioni elettroniche da accesso, uso, divulgazione, interruzione, modifica o distruzione non autorizzati.
Rispettando la 21 CFR Part 11, le aziende possono contribuire a garantire che i loro dati elettronici degli studi clinici siano affidabili e degni di fiducia. Questo è importante perché gli ispettori della FDA sono più propensi ad approvare le presentazioni normative che contengono dati elettronici di studi clinici di alta qualità.
La conformità a 21 CFR Part 11 è fondamentale per una presentazione di successo alla FDA. E, con un software di presentazione come Freyr SUBMIT PRO che centralizza la gestione, migliora la collaborazione e garantisce rapide presentazioni eCTD ed è conforme a 21 CFR Part 11, è possibile raggiungere questo obiettivo. Per saperne di più richiedete una demo ora!









