
Le attività di presentazione e pubblicazione delle normative sono state tradizionalmente laboriose e hanno comportato ore di lavoro manuale per la formattazione dei documenti, la generazione di PDF conformi alle agenzie, i controlli di qualità, l'assemblaggio dei documenti per la presentazione, ecc. A causa delle scadenze impegnative, le aziende del settore delle scienze biologiche si affrettano sempre a presentare i documenti in tempo utile. In tutto il mondo, gli enti regolatori si stanno attrezzando per adottare sviluppi recenti come eCTD v4.0 per la presentazione di dossier, emendamenti e altri rapporti. eCTD v4.0 è un cambiamento incrementale che probabilmente avrà un impatto sul futuro delle presentazioni regolatorie, con tutti i Paesi che si stanno attrezzando per accettarlo e implementarlo.
Considerando tutte le sfide legate alla presentazione di documenti regolatori, la necessità del momento è una soluzione tecnologicamente avanzata per potenziare il processo di presentazione e revisione dei farmaci. Dal momento che le organizzazioni stanno già considerando l'automazione come parte integrante del processo di presentazione delle normative, è fondamentale considerare come questa possa migliorare la produttività durante la transizione a eCTD 4.0.
Come l'automazione aiuta la transizione all'eCTD 4.0?
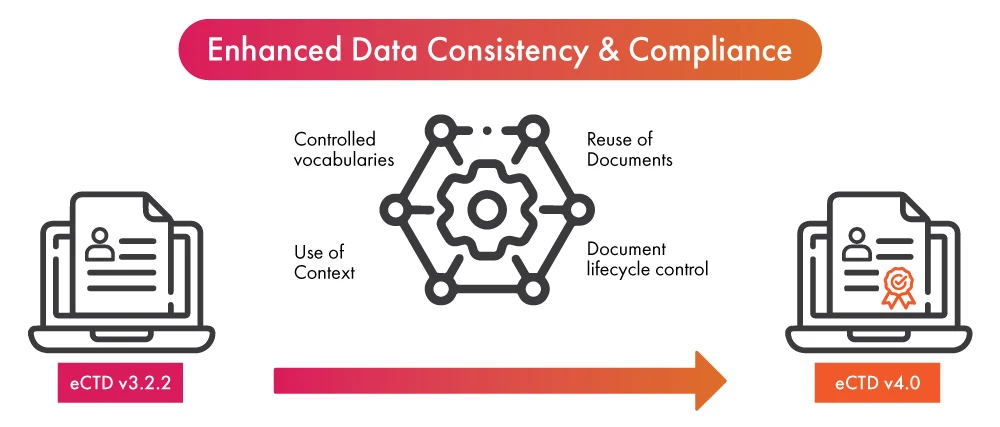
- In procinto di adottare l'ultima versione dell'eCTD, l'implementazione dell'automazione nel processo di presentazione delle normative può portare un doppio vantaggio alle aziende del settore delle scienze della vita: da un lato garantire la conformità all'eCTD v4.0 in tempi più rapidi, dall'altro migliorare la coerenza dei dati e la semplificazione del processo di presentazione.
- Una volta che i dati sono stati finalizzati per l'uso in un (01) deposito normativo, l'automazione rende possibile il popolamento dei dati in altri invii o aggiornamenti. Sfrutta la nuova funzione dell'eCTD v4.0, che ora consente la sostituzione dei dati da molti a uno e da molti a molti, permettendo così il riutilizzo dei dati in modo semplificato.
- Le notifiche automatiche eliminano la necessità di consegnare messaggi o fare telefonate quando l'attività è richiesta. Ciò consente una comunicazione più rapida e chiara che porta a vocabolari controllati, una componente essenziale di eCTD v4.0.
- L'automazione dell'invio dei documenti contribuirà a semplificare ulteriormente il processo di aggiornamento dei contenuti già inviati. Migliorerà il controllo del ciclo di vita dei documenti inviati.
- L'automazione dei gruppi di contesto può accelerare il processo di organizzazione di più file destinati a essere utilizzati per la presentazione di normative.
Nel contesto della transizione all'eCTD v4.0, è fondamentale per le organizzazioni del settore delle scienze della vita collaborare con fornitori che siano pronti per il nuovo standard e comprendano come automatizzare e semplificare il processo di pubblicazione normativa. Le aziende devono prepararsi ad adottare le ultime tecnologie rese possibili dall'automazione per ottenere vantaggi significativi e un vantaggio competitivo sul mercato. L'eCTD v4.0 è un cambiamento importante che arriva dopo molto tempo. Le organizzazioni devono avviare la fase di prova per testare il terreno, poiché presto sarà accettato in molti paesi in tutto il mondo, a seconda delle tempistiche di ciascun paese.
Noi di Freyr all'avanguardia nella promozione dell'innovazione attraverso la tecnologia e siamo pronti a supportare i nostri clienti rendendo disponibile il nostro software per la presentazione e la pubblicazione di documenti normativi:Freyr PRO eCTD v4.0.
Per ulteriori informazioni sulla preparazione Freyrall'eCTD 4.0,clicca qui per scaricare la sessione archiviata del webinar.









