
I dipartimenti normativi devono affrontare una serie di sfide dovute al passaggio dalle presentazioni cartacee a quelle in formato eCTD, che continua in tutto il mondo. La maggior parte delle aziende del settore delle scienze della vita sta lottando duramente per stare al passo con lo USFDA nell'uso del formato eCTD e rispettare la scadenza specificata. L'obbligo del formato eCTD negli US in Canada ha migliorato la procedura di presentazione e l'ha resa più semplice, colmando il divario tra il tempo e il mercato, il che a sua volta contribuisce a ridurre al minimo le spese per le presentazioni elettroniche alle industrie farmaceutiche. Sebbene i vantaggi offerti da questo tipo di presentazione siano molti, essa rimane comunque piuttosto impegnativa per le aziende del settore delle scienze della vita. Di seguito vengono discussi alcuni degli ostacoli che si incontrano nella pubblicazione delle presentazioni USFDA :
- Rapporti annuali - L'eCTD non consente facilmente di redigere il rapporto annuale come un unico documento per questo approccio e può portare a errori di convalida e a problemi e può far sì che la domanda venga respinta.
- Rapporti sugli studi clinici (CSR) - La preparazione di un CSR consente ai revisori di navigare e tracciare facilmente, in modo che anche se la sezione viene aggiornata, il rapporto non debba essere sostituito.
- Collegamento ipertestuale - Uno dei problemi più comuni che gli editori devono affrontare a causa di errori tipografici durante la stesura di un documento è il tentativo di collegare ipertestualmente una sezione che potrebbe non esistere affatto.
- Numerazione dei rapporti - Il problema principale quando la scansione dei dati di uno studio avviene su più rapporti è l'inserimento di un ID di studio univoco per garantire che, in caso di riferimenti incrociati nelle sezioni di riepilogo che si riferiscono al contenuto, questi siano impostati in modo chiaro e facilmente identificabili.
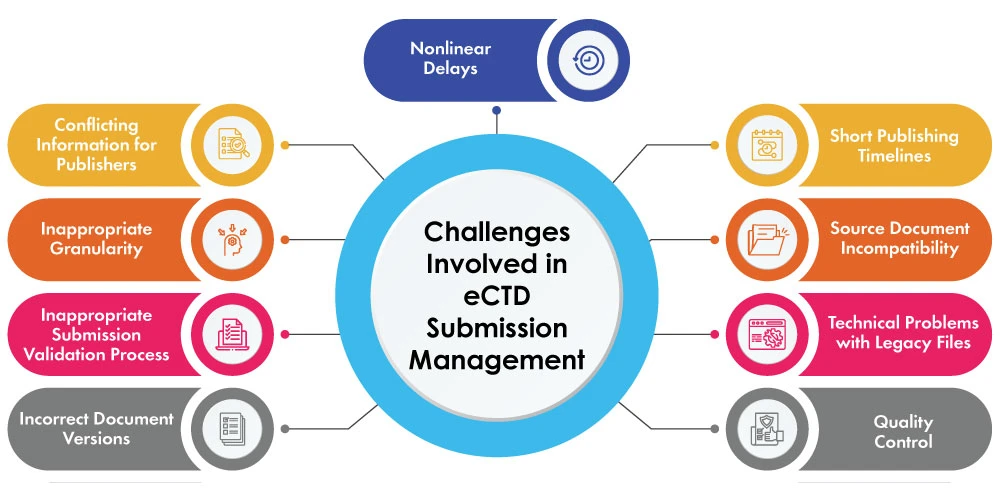
Le sfide legate alla gestione della presentazione di eCTD
Le aziende farmaceutiche sono sottoposte a un'immensa pressione per quanto riguarda le sfide logistiche legate alla gestione delle applicazioni e dei sistemi informatici per la presentazione di documenti privi di errori entro scadenze rigorose. La sfida diventa ancora più ardua quando i costi aumentano o causano ritardi nell'approvazione del documento e, nel peggiore dei casi, si arriva a un rifiuto di deposito. Anche se gli editori possono vantare una grande esperienza, i team di Regulatory publishing incontrano tipicamente i seguenti problemi:
- Informazioni contrastanti per gli editori: A seconda dell'esperienza del team normativo, le informazioni critiche richieste nel processo di pubblicazione sono necessarie da presentare agli editori, ma potrebbero anche essere ambigue, anche se incluse nel contenuto della presentazione. Ad esempio, le presentazioni eCTD si basano fortemente sull'uso di Metadata, inclusi in capacità critiche come i percorsi delle cartelle nell'eCTD finale, che forniscono informazioni aggiuntive sugli elementi. Un modo semplice per prevenire potenziali rilavorazioni è utilizzare procedure e moduli ben progettati, fornendo queste informazioni agli editori contemporaneamente ai file sorgente.
- Granularità inadeguata: Un documento di pubblicazione eCTD prodotto utilizzando un modello di qualità con un livello di granularità appropriato ha un effetto enorme sulla pubblicazione. Se si prevede di presentare una sezione in più fogli, questi dovrebbero essere forniti come numero corrispondente di documenti di origine, anziché essere riuniti in un unico file da separare al momento della pubblicazione. Ogni documento di partenza che deve essere rimandato indietro per la riformattazione è un'altra piccola opportunità per ritardare il progetto.
- Processo di convalida dell'invio inappropriato: Una convalida inappropriata può verificarsi in caso di errori del sistema o dell'editore durante il download dei file. Il principale vantaggio dell'eCTD è la possibilità di verificarne la conformità tecnica al momento della presentazione da parte del richiedente o dell'agenzia.
- Versioni di documenti non corrette: L'obiettivo è quello di completare la pubblicazione di una submission con il documento o la versione di documento corretta, con revisioni QC più intensive. Sono necessarie procedure rigorose per i gruppi che utilizzano le condivisioni di file come repository di pubblicazione. I team editoriali che utilizzano un sistema chiuso di gestione dei documenti (DMS) nei loro flussi di lavoro di pubblicazione generalmente evitano questo problema, poiché solo le versioni contrassegnate come approvate possono essere pubblicate.
- Ritardi non lineari: I ritardi non solo sono talvolta inevitabili, ma possono anche avere effetti negativi sulle tempistiche di presentazione. In una situazione in cui lo slot per la pubblicazione del progetto non può essere spostato indietro nemmeno di un giorno o due a causa del ritardo di altri progetti, il ritardo è destinato a prolungarsi ulteriormente.
- Tempi brevi di pubblicazione: A causa di un processo di presentazione estremamente lungo, il tempo perso nelle fasi precedenti del processo è spesso destinato a essere recuperato durante la pubblicazione. Una delle tecniche più efficaci per risparmiare tempo e sfruttare i rischi del processo di submission è la pubblicazione indipendente dei moduli o delle sezioni della submission.
- Incompatibilità dei documenti di origine: Durante il processo di scansione dei documenti di origine per estrarre automaticamente informazioni diverse dai tipi di file Word/PDF e dagli strumenti di diversi fornitori, i file di origine vengono analizzati e gli elementi come i collegamenti interni al documento, i segnalibri esistenti e gli stili di intestazione/outline vengono elaborati e raccolti nel database del software per creare segnalibri e collegamenti ipertestuali nell'output pubblicato. Se i file di origine non sono impostati secondo le aspettative del software di pubblicazione, questo processo potrebbe richiedere del tempo supplementare per aggiungere manualmente gli elementi di navigazione.
- Problemi tecnici con i file legacy: Anche se nei momenti più critici i file legacy possono essere stati stampati senza problemi in passato, l'editoria elettronica è estremamente efficiente nell'evidenziare i problemi tecnici. In genere i problemi non sono difficili da risolvere, ma richiedono tempo e causano un ritardo, sapendo che lo strumento più importante nella cassetta degli attrezzi dell'editore è il tempo. Una situazione del genere può essere affrontata con largo anticipo dai team che si occupano delle submission editoriali, che utilizzano build incrementali per recuperare i tempi che causano problemi nel processo.
- Controllo qualità: Quando la pubblicazione inizia al momento giusto, il contenuto del file sorgente deve essere definitivo e approvato, poiché la modifica di un documento durante il processo di pubblicazione può allungare ulteriormente la tempistica del progetto. Alcuni dei punti di controllo della qualità che devono essere definiti chiaramente nel corso del progetto per garantire che questi punti siano adeguati al compito di realizzare una presentazione eCTD sono:
- Tutti i documenti di partenza devono essere obbligatoriamente sottoposti a controlli di qualità prima di entrare nel flusso di lavoro di pubblicazione.
- La struttura dell'invio (l'assemblaggio/outline) all'interno del software di pubblicazione deve essere rivista in modo indipendente prima di qualsiasi pubblicazione.
- Tutti i file PDF pubblicati devono essere rivisti sullo schermo.
- Controllare i segnalibri e i collegamenti nei file PDF pubblicati
- Convalidare sempre l'invio di eCTD prima di qualsiasi invio.
(Clicca qui per avere un riferimento)
Freyr Digitale una soluzione a tutte le sfide sopra elencate per le attività di pubblicazione e presentazione della vostra organizzazione. Freyr SUBMIT PRO, un software eCTD ospitato su cloud, consente al nostro team operativo di regolamentazione e agli specialisti di pubblicazione eCTD di fornire un supporto aggiuntivo quando ne avete più bisogno. Freyr garantisce presentazioni efficienti e tempestive grazie al nostro software eCTD supportato da un visualizzatore e validatore eCTD integrato.
Volete saperne di più? Richiedete una demo.









