
L'adozione dell'eCTD 4.0 rappresenta un passo fondamentale verso la modernizzazione delle presentazioni normative a livello mondiale. Con vantaggi quali un miglior tracciamento dei documenti e una maggiore efficienza metadata, non sorprende che le agenzie globali stiano abbracciando questo cambiamento.
Ma qual è EMA ? A differenza della FDA, che ha delineato chiare fasi di implementazione, EMA adottando un approccio più misurato, iniziando con programmi pilota e valutazioni tecniche. In questo blog analizziamo i piani EMAper l'eCTD 4.0, il suo potenziale impatto sulle richieste di autorizzazione e come la vostra azienda può rimanere all'avanguardia.
Ma soprattutto, EMA ha già EMA l'eCTD 4.0? Approfondiamo la questione.
Che cos'è eCTD 4.0 e come si differenzia da eCTD 3.2.2?
L'Electronic Common Technical Document (eCTD) è il formato accettato a livello internazionale per le richieste di autorizzazione. Standardizza il modo in cui le aziende farmaceutiche presentano le richieste di farmaci e gestiscono gli aggiornamenti del ciclo di vita nei diversi mercati.
La versione attuale, eCTD 3.2.2, è in uso da anni. Tuttavia, gli organismi di regolamentazione, tra cui EMA, hanno lavorato allo sviluppo della versione eCTD 4.0, basata sullo standard Health Level 7 (HL7) Regulated Product Submission (RPS). Questo aggiornamento migliora l'efficienza delle presentazioni e la gestione del ciclo di vita normativo.
Principali differenze tra eCTD 3.2.2 ed eCTD 4.0:
- Migliore gestione del ciclo di vita: Migliore tracciabilità delle versioni dei documenti, riducendo le duplicazioni.
- Granularità più flessibile: Consente il riutilizzo di documenti strutturati in diversi invii.
- Metadata migliorata: metadata più strutturati, che rendono più fluide le interazioni normative.
- Maggiore interoperabilità: Progettato per funzionare meglio con i sistemi normativi digitali in evoluzione a livello globale.
- Sebbene questi cambiamenti offrano numerosi vantaggi, il passaggio a eCTD 4.0 richiede preparazione, investimenti e una comprensione delle aspettative normative.
Posizione EMAsull'adozione dell'eCTD 4.0
La grande domanda che tutti si pongono è: EMA ha EMA l'eCTD 4.0? La risposta è ancora no, ma la transizione è in corso.
Stato attuale dell'eCTD 4.0 nell'UE:
- Attualmente, eCTD 3.2.2 rimane lo standard obbligatorio per le presentazioni nell'UE.
- EMA valutato attivamente l'eCTD 4.0, ma non ne ha ancora reso obbligatorio l'uso.
- L'agenzia sta collaborando con altri organismi di regolamentazione, come la FDA PMDA giapponese, per armonizzare gli standard globali.
- Non sono state fissate scadenze ufficiali per la transizione, ma EMA indicato che l'eCTD 4.0 diventerà obbligatorio.
L'approccio EMA: implementazione graduale con un programma pilota
A differenza della USFDA, che ha delineato un piano di implementazione graduale, EMA adottando un approccio strutturato. L'agenzia ha avviato un programma pilota tecnico per testare l'implementazione dell'eCTD 4.0 con le parti interessate del settore.
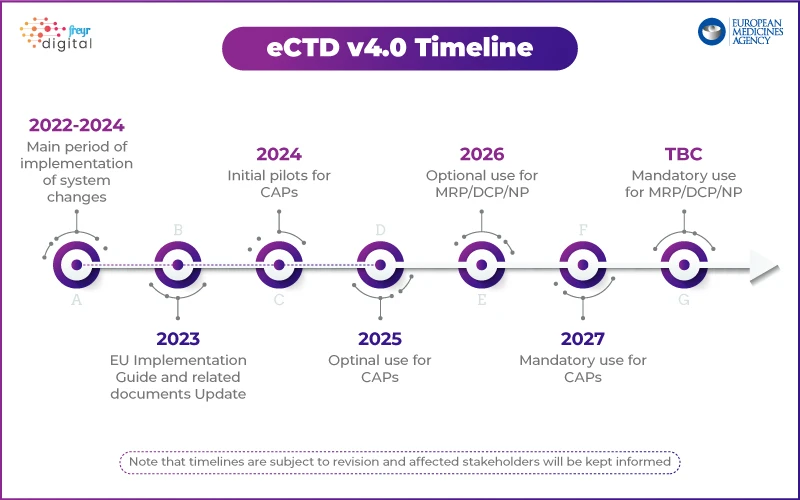
Punti salienti della strategia eCTD 4.0 EMA:
- Fase 1: concentrarsi sull'interoperabilità tecnica con gli strumenti normativi.
- Fasi future: Invio simulato, gestione del ciclo di vita e invio raggruppato.
- È disponibile una bozza di pacchetto di implementazione con vocabolari controllati e criteri di validazione.
EMA impegna a garantire una transizione senza intoppi e le aziende del settore delle scienze della vita dovrebbero seguire gli aggiornamenti sulla pagina ufficiale EMA .
Sfide e considerazioni per le aziende del settore delle scienze biologiche
Sebbene l'eCTD 4.0 offra chiari vantaggi, la sua adozione non è priva di sfide. Ecco alcune considerazioni chiave per le aziende farmaceutiche e biotecnologiche:
- Complessità normative
- La transizione graduale EMA significa che le aziende devono essere preparate a processi di presentazione duale (eCTD 3.2.2 ed eCTD 4.0).
- Le diverse regioni avranno tempi di adozione diversi, il che richiede alle aziende di rimanere agili.
- Sfide tecniche
- La migrazione dei dati da eCTD 3.2.2 a 4.0 richiede un'attenta pianificazione.
- Le regole di convalida cambieranno in modo significativo, richiedendo software e strumenti aggiornati.
- Le aziende devono investire nell'automazione e nelle soluzioni basate sull'intelligenza artificiale per garantire la conformità.
- Rischi di conformità
- metadata errata metadata o il mancato rispetto dei nuovi requisiti di granularità dei documenti potrebbero comportare il rifiuto della presentazione.
- I team di regolamentazione hanno bisogno di una formazione adeguata per comprendere le nuove regole di convalida.
- Impatto sui flussi di lavoro esistenti
- Le aziende dovranno adattare i processi interni per accogliere l'eCTD 4.0.
- Sarà necessaria una maggiore collaborazione tra i team normativi, informatici e di presentazione.
Il punto chiave? Le aziende devono iniziare a prepararsi fin da ora, anche se EMA non EMA ancora reso obbligatorio l'eCTD 4.0.
Come le aziende possono prepararsi alla transizione all'eCTD 4.0 EMA
Sebbene EMA fissato una scadenza ufficiale, le aziende proattive trarranno vantaggio da una preparazione anticipata. Ecco come:
- Valutare gli attuali processi di presentazione
- Identificare le lacune nei flussi di lavoro eCTD 3.2.2 esistenti.
- Valutare come le nuove regole di gestione del ciclo di vita avranno un impatto sulle richieste in corso.
- Investite nei giusti strumenti eCTD 4.0
- Scegliete un software per la presentazione di documenti normativi che sia conforme a eCTD 4.0.
- Assicurarsi che il software supporti gli standard HL7 RPS e metadata .
- Formazione dei team di regolamentazione e IT
- Condurre workshop e sessioni di formazione sui cambiamenti dell'eCTD 4.0.
- Fornire linee guida per metadata e il monitoraggio del ciclo di vita.
- Collabora con EMA i colleghi del settore
- Partecipare ai programmi pilota e alle consultazioni normative EMA.
- Rimani aggiornato sulle ultime linee guida e sugli aggiornamenti normativi EMA.
- Conduzione di test e convalida
- Eseguire invii di test interni utilizzando le strutture di eCTD 4.0.
- Identificare potenziali problemi relativi alla granularità dei documenti e metadata prima del mandato definitivo EMA.
Iniziando ora, le aziende possono assicurarsi una transizione senza problemi e senza interruzioni nella presentazione dei documenti normativi.
Cosa succederà? Il futuro dell'eCTD 4.0 in Europa
Sebbene la tempistica completa della transizione rimanga ancora poco chiara, la strategia a lungo termine EMA prevede:
- Standardizzazione delle richieste nei mercati globali, per migliorare la coerenza e l'efficienza.
- Riduzione dei tempi di approvazione grazie a una migliore tracciabilità del ciclo di vita delle richieste.
- Integrare l'intelligenza artificiale e l'automazione nei flussi di lavoro normativi per migliorare la conformità.
Nei prossimi anni, possiamo aspettarci maggiore chiarezza da parte EMA, compresi i tempi ufficiali di transizione e i nuovi criteri di convalida.
Conclusione
Sebbene EMA non EMA ancora reso obbligatorio l'eCTD 4.0, è solo questione di tempo prima che diventi lo standard per le richieste di autorizzazione all'immissione in commercio nell'UE. Le aziende che si preparano in modo proattivo otterranno un vantaggio competitivo, garantendo la conformità ed evitando ostacoli normativi dell'ultimo minuto.
Punti di forza
- eCTD 3.2.2 rimane lo standard attuale, ma eCTD 4.0 è all'orizzonte.
- EMA adottando un approccio graduale, senza alcun mandato ufficiale.
- Le aziende dovrebbero iniziare a prepararsi fin da ora per garantire una transizione senza problemi.
- È fondamentale investire in nuove tecnologie, formare i team e testare le sottomissioni.
Invito all'azione
Rimani aggiornato sugli annunci normativi EMAe inizia a valutare il tuo grado di preparazione all'eCTD 4.0. Prima ti prepari, più facile sarà la transizione quando entrerà in vigore l'obbligo.
Desideri assistenza nella scelta di un software conforme allo standard eCTD 4.0 o nella comprensione di come questa transizione influirà sulla tua attività? Non esitare a us.









