
Il mondo delle normative farmaceutiche sta per ricevere un importante aggiornamento con l'implementazione dell'eCTD 4.0. Questo formato standardizzato promette un viaggio più agevole per le richieste di nuovi farmaci presentate agli enti regolatori. Ma per le aziende che vogliono accaparrarsi una fetta del mercato farmaceutico giapponese da 141,5 miliardi di dollari, c'è una novità cruciale: il Giappone sta accelerando i tempi di adozione!
Di seguito un'analisi di questi punti salienti:
- Adozione obbligatoria: Contrariamente a quanto avviene in altri settori che prevedono fasi volontarie prima dell'adozione obbligatoria, entro il 2026 il Giappone mira a rendere obbligatorio l'uso di eCTD 4.0.
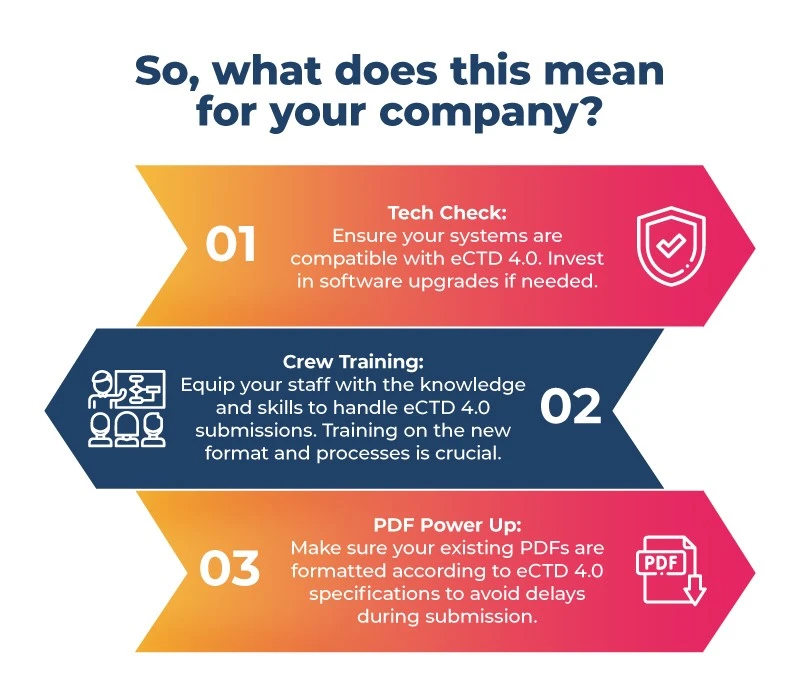
- La preparazione è fondamentale: La preparazione è fondamentale a causa dei vincoli di tempo e dell'assenza di un percorso di migrazione diretto dal formato PMDA giapponese JP1.0 all'eCTD 4.0; concentrarsi su un sistema migliore aiuterà le aziende farmaceutiche in Giappone durante il processo di transizione. Questi passaggi includono l'aggiornamento del software, la formazione del personale e la preparazione dei PDF per il nuovo formato.
- Risorse disponibili: La Pharmaceuticals and Medical Devices Agency (PMDA) del Giappone ha pubblicato risorse che possono guidare le aziende attraverso questo cambiamento, come la "ICH Electronic Common Technical Document eCTD 4.0 Implementation Guide" con spiegazioni sulle modifiche apportate e sulle migliori pratiche disponibili.
Ecco alcuni motivi per cui non dovreste perdere questo gioco di numeri:
- Passaggio rapido all'eCTD 4.0: a differenza di altre regioni in cui il processo è graduale, il Giappone punta all'adozione obbligatoria dell'eCTD 4.0 già nel 2026, ovvero tre anni prima della scadenza fissata dallaFDA US FDA il 2029! Con una tempistica così aggressiva, il Giappone ha assunto un ruolo di primo piano nell'adozione globale dell'eCTD.
- Non c'è spazio per gli errori: JP non può essere convertito direttamente in eCTD 4.0, a differenza delle versioni precedenti. Ciò significa che le aziende farmaceutiche devono essere molto preparate per evitare ritardi nella presentazione, che potrebbero costare loro milioni di dollari.
- Un aiuto per un ingresso agevole: L'Agenzia per i Prodotti Farmaceutici e i Dispositivi Medici (PMDA) del Giappone comprende le sfide. Ha messo a disposizione risorse come guide all'implementazione, progettate per guidare le aziende attraverso queste modifiche con facilità e per un buon ingresso nel mercato giapponese. (https://www.pmda.go.jp/english/).
Se state sviluppando farmaci per l'enorme mercato giapponese, è ora di allacciare le cinture! Ecco la lista di controllo pre-volo:
Il passaggio all'eCTD 4.0 promette una maggiore efficienza e una standardizzazione globale in tutto il processo di approvazione dei farmaci. La vostra azienda può anticipare questo cambiamento in Giappone per una transizione senza intoppi e cogliere le innumerevoli opportunità offerte da questa nuova era. Ricordate che non prepararsi significa prepararsi al fallimento, quindi siate pronti a spiccare il volo con l'eCTD 4.0 in Giappone.
I vantaggi e le opportunità acquisiti sono interessanti per l'industria farmaceutica. Tuttavia, il percorso presenta alcune difficoltà che devono essere risolte. Per orientarsi senza intoppi in un contesto normativo in continua evoluzione, le aziende possono cercare partnership con consulenti affidabili come Freyr. Abbracciate il futuro delle presentazioni normative in Giappone con il nostro impareggiabile software eCTD, Freyr SUBMIT PRO, conforme 21 CFR Part 11 e dotato di un modello di implementazione flessibile. us per saperne di più e intraprendere un percorso verso una maggiore efficienza e successo. Richiedete una demo oggi stesso.









