I costi di conformità per le aziende farmaceutiche possono rappresentare fino al 25% delle loro spese operative totali. Le aziende farmaceutiche con portafogli di prodotti multipli devono affrontare sfide uniche nella gestione della conformità globale, nel monitoraggio dei dossier presentati e nella supervisione delle variazioni di etichettatura. La complessità dei requisiti normativi nelle diverse regioni, unita alla gestione manuale di grandi quantità di dati, può portare a non conformità, ritardi nelle approvazioni di mercato e inefficienze operative.
Questo blog esplora le principali sfide che le aziende farmaceutiche incontrano nella gestione di più portafogli di prodotti e dimostra come il software regolatorio, supportato da casi di studio reali, offra una soluzione strategica a questi problemi.
Le sfide principali nella gestione di portafogli di prodotti multipli
- Requisiti di conformità globali complessi: ogni paese ha il proprio organismo di regolamentazione e i requisiti possono variare notevolmente. Ad esempio, laFDA US , EMA e PMDA giapponese PMDA formati di presentazione, tempistiche e standard di conformità diversi. Le aziende farmaceutiche devono gestire dossier diversi in più regioni, garantendo al contempo il rispetto delle normative locali.
- Tracciare le variazioni delle etichette nelle varie regioni: Gestire le variazioni di etichetta per le diverse regioni e garantire aggiornamenti tempestivi è uno degli aspetti più impegnativi della gestione del portafoglio. Una gestione errata delle modifiche alle etichette può portare alla non conformità, al ritiro dei prodotti e a gravi problemi finanziari.
- Sovraccarico di presentazione dei dossier: La presentazione e la gestione dei dossier di più linee di prodotto, ciascuna in diverse fasi di sviluppo, può rapidamente sovraccaricare i team interni. Gestire manualmente gli aggiornamenti del ciclo di vita del prodotto comporta spesso errori e ritardi nelle approvazioni.
- Cattiva gestione delle risorse: I team spesso faticano ad allocare le risorse giuste in modo efficiente. Senza un solido sistema di gestione, le aziende possono sovraccaricare il personale di compiti amministrativi, limitando la loro capacità di concentrarsi sulle attività strategiche principali.
- Silos di dati: la mancanza di centralizzazione significa che i dati relativi alle richieste, alle approvazioni e agli aggiornamenti dei prodotti sono archiviati in sistemi diversi, con conseguenti inefficienze, errori di comunicazione e difficoltà nel mantenere una visione olistica del ciclo di vita del prodotto.
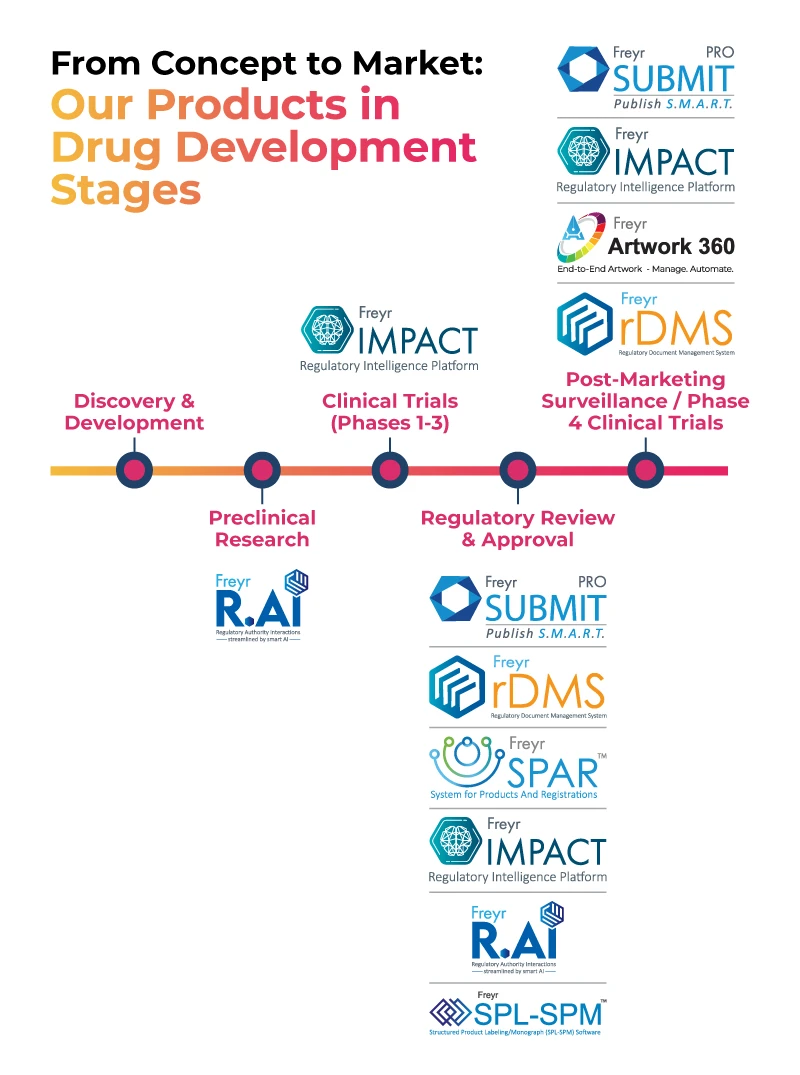
La suite di prodotti tecnologici Freyr Digitale supporta le aziende farmaceutiche dal concept al mercato, come illustrato nell'immagine sottostante.
Casi di studio: Come i software di regolamentazione forniscono un vantaggio strategico
Grazie all'adozione di un software regolatorio, le aziende farmaceutiche possono automatizzare i processi, garantire la conformità e, in ultima analisi, ottenere un vantaggio strategico sui concorrenti. I seguenti casi di studio evidenziano esempi reali di come le nostre soluzioni software regolatorie abbiano aiutato le aziende farmaceutiche a superare queste sfide.
Caso provato
La sfida del cliente
Un'azienda farmaceutica US produttrice di farmaci generici aveva difficoltà a gestire in modo efficiente le richieste end-to-end e la gestione dei documenti. Si trovava ad affrontare il problema della dispersione degli archivi documentali, che rendeva difficile garantire un accesso agevole ai documenti normativi sia agli stakeholder interni che a quelli esterni. Inoltre, il processo di creazione e gestione Structured Product Labeling (SPL) macchinoso, causando ritardi nelle tempistiche di presentazione delle richieste e un aumento dei cicli di revisione.
La soluzione Freyr Digitale
Freyr Digitale come fornitore di soluzioni virtuali per gli affari regolatori, implementando questi tre prodotti chiave come soluzioni per affrontare le sfide del cliente:
- Freyr : un sistema centralizzato di gestione dei documenti che funge da fonte unica di verità per tutte le richieste di autorizzazione e i documenti normativi, garantendo l'accesso in tempo reale e il controllo delle versioni sia per i team interni che per i partner esterni.
- Freyr PRO: un potente strumento per la pubblicazione e l'invio di documenti eCTD, che semplifica il processo di invio, riduce i tempi di preparazione e garantisce la conformità alle norme regolamentari in continua evoluzione.
- Freyr : una soluzione efficiente per la gestione di tutte le attività relative all'SPL, che migliora significativamente i processi di creazione, gestione e presentazione dei documenti.
Risultati
Implementando queste soluzioni, Freyr Digitale il cliente a ottenere:
- Riduzione del 30% dei tempi di preparazione delle domande
- 100% di conformità a tutti i requisiti normativi
- Un miglioramento del 40% nell'efficienza dell'elaborazione dei documenti
- Riduzione del 25% dei cicli di revisione
Conclusione: Abbracciare la trasformazione digitale per il successo strategico
Gestire più portafogli di prodotti nei mercati globali non è un'impresa da poco. Tuttavia, con il giusto software regolatorio, le aziende farmaceutiche possono snellire i processi, garantire la conformità e ottenere un vantaggio strategico nel settore.
Freyr Digitale, che comprende Freyr SUBMIT PRO, Freyr rDMSe Freyr SPL-SPM hanno costantemente aiutato le aziende farmaceutiche a ridurre i tempi di presentazione, migliorare la conformità e ottimizzare le risorse. Automatizzando i processi manuali, fornendo una gestione centralizzata dei dati e offrendo approfondimenti in tempo reale, le nostre soluzioni consentono alle aziende farmaceutiche di rimanere all'avanguardia in un mercato competitivo. Contattateci.









