
L'industria farmaceutica cinese ha registrato una crescita sostanziale dopo il suo ingresso nell'Organizzazione Mondiale del Commercio (OMC). Nel 2021, la Cina deterrà una quota del 12% del mercato farmaceutico globale, diventando così il secondo maggior contributore. Secondo l'agenzia di stampa Xinhua, il mercato farmaceutico cinese genererà 708,75 miliardi di yuan nel 2021, mentre le aziende farmaceutiche nazionali cinesi avranno accumulato 502 miliardi di dollari di profitti.
Come forse saprete, la National Medical Products Administration (NMPA), l'Autorità sanitaria cinese, ha iniziato ad accettare le domande di autorizzazione all'immissione in commercio (MA) eCTD, nonché le domande di autorizzazione per studi clinici (CTA), aprendo la strada a maggiori opportunità. Tuttavia, ciò comporta una serie di sfide.
In questo blog esaminiamo il mondo della presentazione di documenti tecnici comuni elettronici (eCTD), che sta rapidamente diventando il metodo preferito per la presentazione di documenti nell'industria farmaceutica.
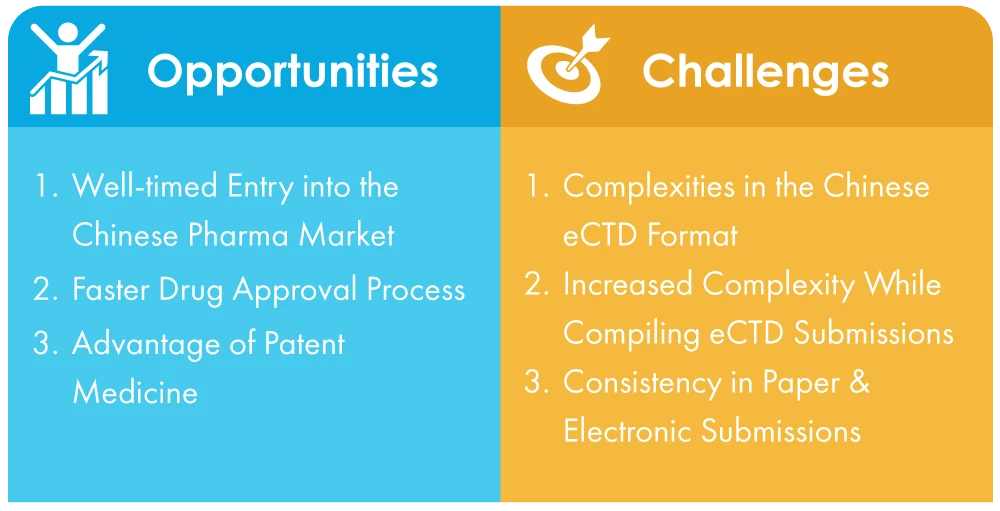
Le sfide affrontate dalle aziende in Cina per adattarsi all'obbligo di presentazione di eCTD
- Complessità del formato eCTD cinese: A differenza dello standard universale, che è piuttosto semplice, il formato eCTD cinese è complicato e può essere difficile da superare per le aziende che non hanno familiarità con il processo. Ciò può comportare dei contrattempi nella presentazione delle credenziali essenziali.
- Aumento della complessità nella compilazione delle presentazioni eCTD: NMPA, l'Autorità Sanitaria della Cina, ha implementato nuove regole e regolamenti per supportare la transizione alle presentazioni elettroniche, ma le aziende devono comunque orientarsi in un ambiente complesso e dinamico. Ciò può essere più impegnativo per le aziende che non hanno una presenza locale o una comprensione approfondita dell'ecosistema normativo cinese.
- Supporto multilingue per la presentazione di documenti cartacei ed elettronici: I documenti devono essere presentati in mandarino con le versioni in inglese come riferimento, il che può essere un compito difficile per le aziende che non dispongono di affiliazioni con traduttori linguistici qualificati.
Opportunità durante la transizione dalla carta all'invio senza carta
- Ingresso tempestivo nel mercato farmaceutico cinese: Entrare nel mercato cinese è diventato più conveniente grazie alle riforme e agli aggiornamenti politici attuati. Uno dei cambiamenti principali è l'adozione della presentazione elettronica, che snellisce il processo ed elimina molte delle sfide che le aziende dovevano affrontare in passato. Questo testimonia l'impegno della Cina nel promuovere gli adeguamenti strutturali, le trasformazioni procedurali e la crescita complessiva del mercato.
- Processo di approvazione dei farmaci più rapido: Ora che le richieste sono diventate elettroniche, il processo di approvazione dei farmaci sarà molto più rapido e quindi il processo di immissione sul mercato dei medicinali sarà più fluido e veloce. Questo aiuterà le grandi aziende farmaceutiche ad aumentare ulteriormente la quota della Cina nel mercato farmaceutico globale.
- Vantaggi della medicina brevettata: La medicina brevettata è il secondo segmento di prodotti con grandi margini di profitto. Tuttavia, la produzione di farmaci originator comporta lunghi periodi di restituzione, costi di R&S elevati e periodi di R&S prolungati. Con l'implementazione della presentazione elettronica, tutti questi ostacoli possono essere affrontati. A partire dal 2022, le aziende straniere sono ancora i principali partecipanti a questo mercato. Si tratta quindi di un mercato di nicchia a cui rivolgersi.
Come essere pronti per questa nuova implementazione in Cina?
Il passaggio alla presentazione obbligatoria dei documenti eCTD in Cina offre numerose opportunità alle aziende che desiderano rimanere competitive nel più grande mercato farmaceutico mondiale. Collaborando con gli esperti giusti, le aziende possono orientarsi con facilità e sicurezza nel panorama normativo in continua evoluzione. Per rimanere all'avanguardia, è fondamentale avere una filiale con una presenza locale e una conoscenza approfondita delle normative HA. Freyr SUBMIT PRO, un software di pubblicazione e presentazione, aiuta produttori entrare con facilità nel mercato farmaceutico cinese. Per saperne di più sullo strumento, richiedete una demo.









