
L'idea di presentare le richieste di autorizzazione per i prodotti farmaceutici in formato elettronico è antecedente allo strumento eCTD stesso. Alla fine degli anni '80, iniziative come CANDA (Computer-Aided New Drug Application) sono state prese in esame dallaFDA Food and Drug Administration) US e dalle agenzie europee. Questi primi tentativi miravano a migliorare l'efficienza e l'accesso ai dati per i revisori.
Inserire lo standard eCTD (2003):
Nel 2003, l'International Conference on Harmonisation (ICH) ha introdotto una novità rivoluzionaria: lo standard eCTD (electronic Common Technical Document). Questo formato standardizzato è stato progettato per stabilire un linguaggio universale per le presentazioni elettroniche in tutto il mondo.
L'emergere di strumenti di eCTD:
Con l'adozione dello standard eCTD, è aumentata la richiesta di strumenti eCTD specializzati. Questi strumenti hanno portato diversi vantaggi fondamentali:
- Creazione di contenuti semplificata: Gli utenti possono creare e organizzare facilmente i documenti in linea con la struttura eCTD.
- Validazione robusta: gli strumenti eCTD hanno garantito la conformità dei documenti inviati alle specifiche tecniche, evitando ritardi causati da errori di formattazione.
- Gestione efficiente del ciclo di vita: La gestione delle revisioni, il monitoraggio delle versioni e il mantenimento della conformità normativa diventano più semplici.
Queste innovazioni hanno rivoluzionato il processo di presentazione delle normative, rendendolo più efficiente e affidabile.
Come il software Freyr Digitaleautomatizza la creazione di eCTD
La soluzione software avanzata Freyr Digitale, Freyr SUBMIT PRO, affronta queste sfide automatizzando gli aspetti chiave della creazione di eCTD, migliorando così l'efficienza e riducendo gli errori umani.
Ottimizzazione delle risorse: Automatizzando le attività ripetitive, il nostro software libera preziose risorse umane. I professionisti possono concentrarsi su attività più strategiche e di alto valore, come l'analisi dei dati, lo sviluppo di strategie normative e il coinvolgimento delle parti interessate. Questo spostamento non solo aumenta la produttività, ma riduce anche i costi operativi, garantendo un significativo ritorno sull'investimento.
Riduzione del rischio di errore umano: L'automazione riduce al minimo il rischio di errori umani, garantendo il trasferimento accurato dei dati e la corretta formattazione dei documenti. I controlli di convalida e i meccanismi di rilevamento degli errori integrati nel software migliorano ulteriormente la qualità e la conformità delle proposte normative. Ciò riduce la necessità di rielaborazione e contribuisce a garantire approvazioni tempestive.
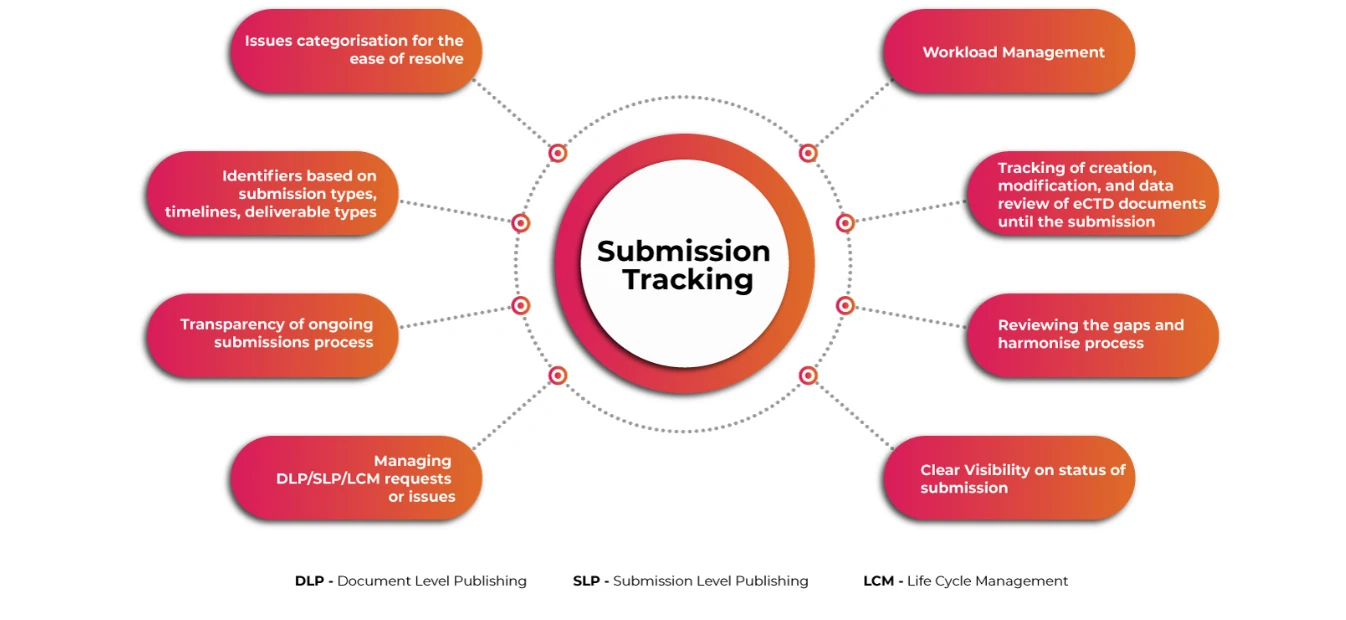
Submissions Tracker per una visione completa delle proposte di eCTD
Un sistema automatizzato di facile utilizzo per la pianificazione e il monitoraggio delle complesse attività di presentazione di eCTD a livello globale, la gestione del flusso di lavoro delle attività, l'archiviazione e la gestione delle domande di registrazione e delle informazioni di presentazione è indispensabile per garantire che i richiedenti affrontino le sfide associate con largo anticipo. La visibilità delle operazioni di presentazione e pubblicazione a livello granulare rende l'intero processo di presentazione più fluido e veloce.
Tracciabilità dell'invio
L'ultimo aggiornamento di eCTD
Il passaggio all'eCTD 4.0 preannuncia una maggiore efficienza e una standardizzazione globale nel processo di approvazione dei farmaci. Preparandosi a questa transizione, la vostra azienda potrà affrontare il cambiamento senza intoppi e sfruttare le numerose opportunità era questa nuova era . Il passaggio all'eCTD 4.0 può comportare alcune sfide, ma queste sono superabili con l'impegno e la determinazione di tutti i paesi coinvolti. Sebbene siano necessari investimenti e sforzi significativi, i vantaggi sostanziali dell'eCTD 4.0 rendono lo sforzo davvero utile.
Revisione del processo di presentazione: eCTD 4.0 promette di rivoluzionare il modo in cui le aziende farmaceutiche presentano i dati sullo sviluppo dei farmaci alle autorità sanitarie. L'obiettivo è quello di snellire il processo di presentazione.
Tempistiche di implementazione: la FDA di accettare nuove domande in formato eCTD 4.0 a partire dal 2024. Le fasi future riguarderanno le domande esistenti in formato v3.2.2 e la comunicazione bidirezionale.
Compatibilità con il futuro: eCTD 4.0 include la compatibilità con il futuro, consentendo il riutilizzo del ciclo di vita e dei documenti dei contenuti della v3.2.2. Ciò semplifica la conversione delle applicazioni v3.2.2 in eCTD 4.0.
Criteri di convalida: Sono disponibili le specifiche per i criteri di convalida dell'eCTD 4.0. Questi criteri assicurano la qualità e l'accuratezza dei documenti inviati.
Conformità globale: Entro il 2026, gli enti normativi di tutto il mondo potrebbero richiedere la conformità agli standard eCTD 4.0. Sebbene attualmente sia volontaria, l'applicazione inizierà tra il 2026 e il 2029.
Il futuro dell'eCTD:
È necessario accogliere con favore l'IA e rendere dinamica la funzione di regolamentazione, poiché essa aggiunge valore alla vostra attività. Freya Fusion è una piattaforma all'avanguardia, basata sull'intelligenza artificiale e cloud-native per la gestione delle informazioni normative (RIM) che offre prestazioni, sicurezza e scalabilità eccezionali, il tutto mantenendo una rigorosa conformità GxP. Migliorata con funzionalità avanzateML automazione, Freya Fusion nel regno digitale, fornendo funzionalità superiori e un'esperienza utente eccezionale. I progressi dell'intelligenza artificiale di Freyr Digitale moduli di produzione e tracciamento delle presentazioni, che comprendono funzionalità per la compilazione, la pubblicazione e la convalida senza soluzione di continuità delle presentazioni normative, garantendo una meticolosa conformità alle linee guida eCTD. Rimanere all'avanguardia nel campo della conformità normativa con SaaS basato sull'intelligenza artificiale porterà sicuramente vantaggi alla vostra azienda. Che si tratti di un sistema di allerta precoce per i cambiamenti normativi, di una revisione e analisi semplificata dei documenti normativi o di analisi predittive per la gestione dei rischi, Freyr Digitale tutto ciò che vi serve. Reach hello@freyrdigital.comper scoprire le nostre innovazioniML che semplificano le operazioni normative nel settore medico.
Rimani al passo con i tempi grazie ad aggiornamenti regolari e progressi tecnologici. Collabora con us semplificare le tue operazioni normative, aumentare la produttività e migliorare la qualità delle presentazioni. Richiedi una demo oggi stesso e prova la combinazione perfetta di competenze e strumenti. Porta la tua organizzazione dall'eccellenza alla perfezione. us oggi stesso.









