
Nel dinamico mondo dei prodotti farmaceutici, il ruolo dei dati del mondo reale (RWD) e delle prove del mondo reale (RWE) sta diventando sempre più cruciale. Questi strumenti forniscono un ponte tra l'ambiente controllato degli studi clinici e le complessità del mondo reale dell'assistenza ai pazienti. Diverse aziende farmaceutiche hanno utilizzato con successo RWD/RWE per supportare le loro presentazioni normative. Ad esempio, nel 2022, Bristol Myers Squibb ha ricevuto l'approvazione della FDA per l'uso di Opdivo (nivolumab) in combinazione con Yervoy (ipilimumab) per il trattamento del melanoma metastatico di prima linea, basata sui dati RWE dello studio CheckMate 151.
Con la recente bozza di guida della FDA dell'ottobre 2023 che apre la strada, è tempo per gli innovatori farmaceutici di sfruttare il potenziale di RWD e RWE per le presentazioni normative.
RWD/RWE può essere utilizzato per supportare una serie di richieste normative, tra cui:
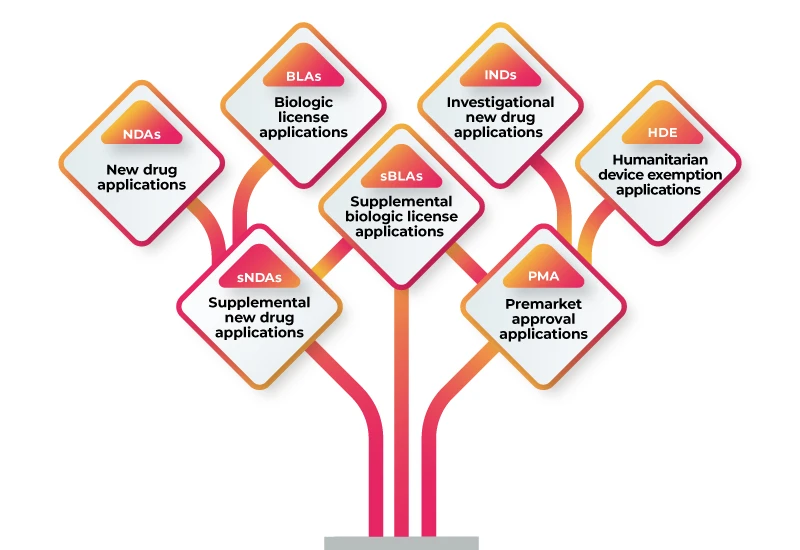
Per utilizzare RWD/RWE a supporto della presentazione normativa, è necessario seguire i seguenti passaggi:
Fase 1: Definire la domanda normativa
Iniziate il vostro viaggio identificando la questione normativa principale che intendete affrontare. Che si tratti di sicurezza, efficacia o prestazioni in scenari reali, la chiarezza del vostro obiettivo è fondamentale.
Fase 2: Selezionare fonti RWD di qualità
La chiave è la qualità. Scegliete fonti RWD che siano direttamente correlate alla vostra domanda normativa. Le cartelle cliniche elettroniche, i dati sulle richieste di risarcimento e i registri dei pazienti sono risorse preziose.
Fase 3: Creare un progetto di studio valido
Il design del vostro studio dovrebbe riflettere la vostra domanda normativa e aderire alle linee guida normative. Il vostro approccio deve allinearsi alle aspettative della FDA.
Fase 4: Analisi e generazione di RWE
Utilizzate metodi statistici solidi per le vostre analisi. Una documentazione chiara è essenziale per garantire trasparenza e credibilità.
Fase 5: Interpretazione e presentazione dei risultati
L'obiettività è la pietra miliare dell'interpretazione della RWE. La presentazione deve essere adattata al pubblico, trasmettendo la totalità delle prove con precisione.
Ecco alcuni suggerimenti per l'utilizzo di RWD/RWE a supporto della presentazione normativa:
- Integrare, non sostituire gli studi clinici: La RWD/RWE migliora le prove di sicurezza ed efficacia, ma non sostituisce gli studi clinici ben progettati.
- Limitazioni trasparenti: Riconoscere la natura osservazionale della RWD/RWE, i potenziali pregiudizi e i fattori di confondimento non controllati.
- Collaborare con gli enti normativi: Lavorare a stretto contatto con gli enti normativi per allineare l'uso di RWD/RWE alle loro aspettative.
Seguendo questi passaggi e suggerimenti, potrete utilizzare RWD/RWE per supportare la vostra presentazione normativa e portare il vostro prodotto sul mercato in modo più rapido ed efficiente.
Mentre intraprendete questo viaggio nella RWD e nella RWE, ricordate che state spianando la strada per una presentazione regolatoria più efficiente e informata. Il futuro dell'innovazione farmaceutica risiede nell'evidenza del mondo reale. Abbracciatela, sfruttatela e lasciate il vostro segno nel settore.
Pronto a semplificare il tuo processo di presentazione normativa? Scopri oggi stesso il nostro software all'avanguardia per la presentazione normativa Freyr SUBMIT PRO!









